Нарушения сердечного ритма и проводимости (с указанием формы). 4 страница
Стресс-эхокардиография. При хронических формах ИБС исследование локальной сократимости миокарда ЛЖ в покое далеко не всегда бывает информативным. Возможности ультразвукового метода исследования существенно расширяются при использовании метода стресс-эхокардиографии — регистрации нарушений локальной сократимости миокарда с помощью двухмерной эхокардиографии во время нагрузки.
Чаще используют динамическую физическую нагрузку (тредмил или велоэргометрия в сидячем или лежачем положении), пробы с дипиридамолом, добутамином или чреспищеводную электростимуляцию сердца (ЧПЭС). Способы проведения нагрузочных тестов и критерии прекращения пробы не отличаются от таковых, используемых при классической электрокардиографии. Двухмерные эхокардиограммы регистрируют в горизонтальном положении пациента до начала исследования и сразу после окончания нагрузки (в течение 60–90 с).
Для выявления нарушений локальной сократимости миокарда используют специальные компьютерные программы, позволяющие оценить степень изменения движения миокарда и его утолщения во время нагрузки (“стресса”) в 16 (или другом количестве) предварительно визуализированных сегментов ЛЖ. Результаты исследования практически не зависят от вида нагрузки, хотя более удобной является ЧПЭС и дипиридамоловая или добутаминовая пробы, поскольку все исследования проводятся в горизонтальном положении пациента.
Чувствительность и специфичность стресс-эхокардиографии в диагностике ИБС достигает 80–90%. Главный недостаток этого метода состоит в том, что результаты исследования существенно зависят от квалификации специалиста, вручную устанавливающего границы эндокарда, которые в дальнейшем и используются для автоматического вычисления локальной сократимости отдельных сегментов.
Исследование жизнеспособности миокарда.Эхокардиография, наряду со сцинтиграфией миокарда с 201Т1 и позитронной эмиссионной томографией, широко используется в последнее время для диагности жизнеспособности “гибернирующего” или “оглушенного” миокарда. С этой целью используют обычно добутаминовый тест. Поскольку даже малые дозы добутамина обладают выраженным положительным инотропным действием, сократимость жизнеспособного миокарда, как правило, возрастает, что сопровождается временным уменьшением или исчезновением эхокардиографических признаков локальной гипокинезии. Эти данные являются основанием для диагностики “гибернирующего” или “оглушенного” миокарда, что имеет важное прогностическое значение, в частности, для определения показаний к хирургическому лечению больных ИБС. Следует, правда, иметь в виду, что при более высоких дозах добутамина усугубляются признаки ишемии миокарда и сократимость вновь падает. Таким образом, при проведении добутаминового теста можно встретиться с двухфазной реакцией сократительного миокарда на введение положительного инотропного агента.
Коронароангиография
Коронароангиография (КАГ) — это метод рентгенологического исследования коронарных артерий сердца (КА) с помощью селективного заполнения венечных сосудов контрастным веществом. Являясь “золотым стандартом” в диагностике ИБС, коронароангиография позволяет определить характер, локализацию и степень атеросклеротического сужения КА, протяженность патологического процесса, состояние коллатерального кровообращения, а также выявить некоторые врожденные пороки развития венечных сосудов, например, аномальное отхождение КА или коронарный артериовенозный свищ. Кроме того, при выполнении КАГ, как правило, производят левую вентрикулографию, что дает возможность оценить ряд важных гемодинамических параметров (см. выше). Полученные при КАГ данные очень важны при выборе метода хирургической коррекции обструктивных поражений КА.
Показания и противопоказания
Показания.В соответствии с рекомендациямиЕвропейского общества кардиологов (1997) наиболее общими показаниями для проведения плановой КАГ являются уточнение характера, степени и локализации поражения КА и оценка нарушений сократительной способности ЛЖ (по данным левой вентрикулографии) у больных ИБС, подлежащих хирургическому лечению, в том числе:
- больные с хроническими формами ИБС (стабильная стенокардия напряжения III–IV ФК) при неэффективности консервативной антиангинальной терапии;
- больные стабильной стенокардией напряжения I–II ФК, перенесшие ИМ;
- больные с постинфарктной аневризмой и прогрессирующей, преимущественно левожелудочковой, сердечной недостаточностью;
- больные стабильной стенокардией напряжения с блокадой ножек пучка Гиса в сочетании с признаками ишемии миокарда по данным сцинтиграфии миокарда;
- больные ИБС в сочетании с аортальными пороками сердца, требующими хирургической коррекции;
- больные с облитерирующим атеросклерозом артерий нижних конечностей, направляемые на хирургическое лечение;
- больные ИБС с тяжелыми нарушениями ритма сердца, требующими уточнения генеза и хирургической коррекции.
В ряде случаев плановая КАГ показана также для верификации диагноза ИБС у больных с болями в области сердца и некоторыми другими симптомами, генез которых не удалось установить с помощью неинвазивных методов исследования, включая ЭКГ12, функциональные нагрузочные пробы, суточное мониторирование ЭКГ по Холтеру и т.п. Однако в этих случаях врач, направляющий такого пациента в специализированное учреждение для проведения КАГ, должен быть особенно осторожен и учитывать многие факторы, определяющие целесообразность этого исследования и риск его осложнений.
Показания для проведения экстренной КАГ у больных острым коронарным синдромом представлены в главе 6 настоящего руководства.
Противопоказания. Проведение КАГ противопоказано:
- при наличии лихорадки;
- при тяжелых заболеваниях паренхиматозных органов;
- при выраженной тотальной (лево- и правожелудочковой) сердечной недостаточности;
- при острых нарушениях мозгового кровообращения;
- при тяжелых нарушениях желудочкового ритма.
Методика исследования
В настоящее время используют главным образом две методики КАГ. Наиболее часто применяется методика Джадкинса, при которой специальный катетер вводят путем чрескожной пункции в бедренную артерию, а затем ретроградно в аорту (рис. 5.38). В устье правой и левой КА вводят по 5–10 мл рентгеноконтрастного вещества и в нескольких проекциях осуществляют рентгеновскую кино- или видеосъемку, позволяющую получить динамические изображения коронарного русла. В тех случаях, когда у пациента имеется окклюзия обеих бедренных артерий, используют методику Соунса, при которой катетер вводят в обнаженную плечевую артерию.
| Рис. 5.38. Схема ретроградного артериального доступа при катетеризации левых отделов сердца. Катетер введен в бедренную артерию, аорту и левые отделы сердца (ЛЖ и ЛП) | 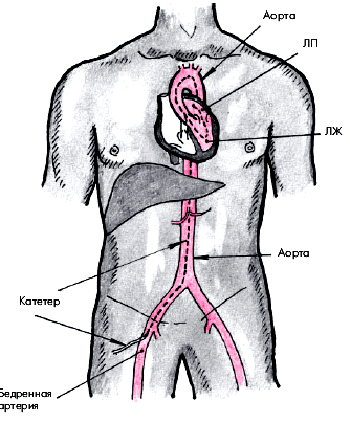
|
К числу наиболее тяжелых осложнений, которые могут возникнуть при проведении КАГ, относятся: 1) нарушения ритма, в том числе желудочковая тахикардия и фибрилляция желудочков; 2) развитие острого ИМ; 3) внезапная смерть.
Интерпретация результатов
При анализе коронарограмм оценивают несколько признаков, достаточно полно характеризующих изменения коронарного русла при ИБС (Ю.С. Петросян и Л.С. Зингерман).
1. Анатомический тип кровоснабжения сердца: правый, левый, сбалансированный (равномерный).
2. Локализация поражений: а) ствол ЛКА; б) ПМЖВ ЛКА; в) ОВ ЛКА; г) передняя диагональная ветвь ЛКА; д) ПКА; е) краевая ветвь ПКА и другие ветви КА.
3. Распространенность поражения: а) локализованная форма (в проксимальной, средней или дистальной трети КА); б) диффузное поражение.
4. Степень сужения просвета:
а. I степень — на 50%;
б. II степень — от 50 до 75%;
в. III степень — более 75%;
г. IV степень — окклюзия КА.
Левый анатомический тип характеризуется преобладанием кровоснабжения за счет ЛКА. Последняя участвует в васкуляризации всего ЛП и ЛЖ, всей МЖП, задней стенки ПП, большей части задней стенки ПЖ и части передней стенки ПЖ, прилежащей к МЖП. ПКА кровоснабжает при этом типе только часть передней стенки ПЖ, а также переднюю и боковую стенки ПП.
При правом типе большая часть сердца (все ПП, большая часть передней и вся задняя стенка ПЖ, задние 2/3 МЖП, задняя стенка ЛЖ и ЛП, верхушка сердца) кровоснабжается за счет ПКА и ее ветвей. ЛКА при этом типе кровоснабжает переднюю и боковую стенки ЛЖ, переднюю треть МЖП, переднюю и боковую стенки ЛП.
Чаще (примерно в 80–85% случаев) встречаются различные варианты сбалансированного (равномерного) типа кровоснабжения сердца, при котором ЛКА кровоснабжает все ЛП, переднюю, боковую и большую часть задней стенки ЛЖ, передние 2/3 МЖП и небольшую часть передней стенки ПЖ, прилегающую к МЖП. ПКА участвует в васкуляризации всего ПП, большей части передней и всей задней стенки ПЖ, задней трети МЖП и небольшой части задней стенки ЛЖ.
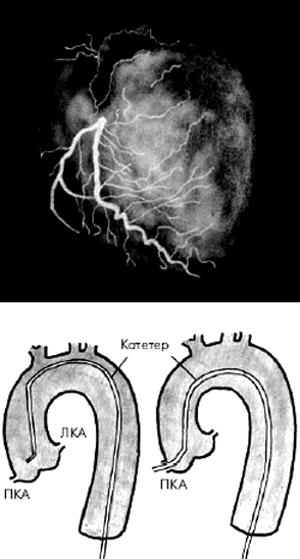
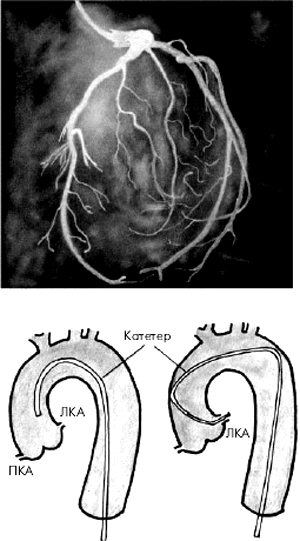
Во время проведения селективной КАГ контрастное вещество последовательно вводится в ПКА (рис. 5.39) и в ЛКА (рис. 5.40), что позволяет получить картину коронарного кровоснабжения раздельно для бассейнов ПКА и ЛКА. У больных ИБС по данным КАГ наиболее часто выявляется атеросклеротическое сужение 2–3-х КА — ПМЖВ, ОВ и ПКА. Поражение этих сосудов имеет очень важное диагностическое и прогностическое значение, поскольку сопровождается возникновением ишемических повреждений значительных участков миокарда (рис. 5.41).
|
| Рис. 5.39. Селективная коронароангиограмма (КАГ) правой коронарной артерии и схематическое изображение техники зондирования артерии |
|
| Рис. 5.40. Селективная коронароангиограмма (КАГ) левой коронарной артерии и схематическое изображение техники зондирования артерии |
| Рис. 5.41. Коронароангиограмма, зарегистрированная у больного с критическим стенозом правой коронарной артерии (показан стрелкой) | 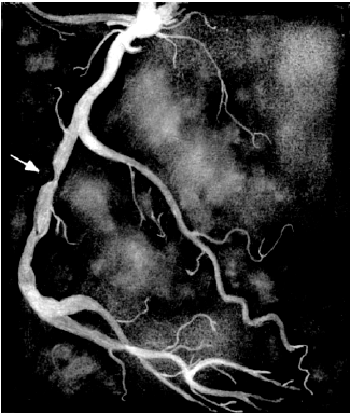
|
 Запомните
Наиболее тяжелое течение заболевания и наихудший прогноз отмечаются при поражении ствола ЛКА. Имеется также четкая зависимость тяжести течения ИБС и числа пораженных КА: наихудший прогноз наблюдается при гемодинамически значимом сужении трех основных КА (ПМЖВ, ОВ и ПКА). Запомните
Наиболее тяжелое течение заболевания и наихудший прогноз отмечаются при поражении ствола ЛКА. Имеется также четкая зависимость тяжести течения ИБС и числа пораженных КА: наихудший прогноз наблюдается при гемодинамически значимом сужении трех основных КА (ПМЖВ, ОВ и ПКА).
|
Степень сужения КА также имеет важное прогностическое значение. Гемодинамически значимым считают сужение просвета венечных артерий на 70% и больше. Стеноз КА до 50% расценивается как гемодинамически незначимый. Однако следует иметь в виду, что конкретные клинические проявления ИБС зависят не только от степени сужения КА, но и от многих других факторов, например, от степени развития коллатерального кровотока, состояния системы гемостаза, вегетативной регуляции сосудистого тонуса, склонности к спазму венечных артерий и др. Иными словами, даже при относительно малом сужении КА или при его отсутствии (по данным КАГ) при определенных обстоятельствах может развиться обширный острый ИМ. С другой стороны, нередки случаи, когда при хорошо развитой сети коллатеральных сосудов даже полная окклюзия одной КА длительное время может не сопровождаться возникновением ИМ.
Оценка характера коллатерального кровообращения имеет, таким образом, важное диагностическое значение. Обычно при значительном и распространенном поражении КА и длительном течении ИБС при КАГ выявляется хорошо развитая сеть коллатералей (см. рис. 5.39), тогда как у больных с “коротким” ишемическим анамнезом и стенозом одной КА коллатеральное кровообращение выражено хуже. Последнее обстоятельство имеет особое значение в случаях внезапного тромбоза, сопровождающегося, как правило, возникновением распространенного и трансмурального некроза сердечной мышцы (например, у сравнительно молодых больных ИБС).
 Запомните
К числу признаков нарушения коронарного кровообращения, выявляемых у больных ИБС при КАГ и имеющих особенно неблагоприятное прогностическое значение, относятся: 1. Поражение ствола ЛКА. 2. Трехсосудистое поражение КА (ПМЖВ, ОВ и ПКА). 3. Сужение просвета венечных артерий на 70% и больше (особенно окклюзия КА). 4. Слабое развитие коллатерального кровообращения. Запомните
К числу признаков нарушения коронарного кровообращения, выявляемых у больных ИБС при КАГ и имеющих особенно неблагоприятное прогностическое значение, относятся: 1. Поражение ствола ЛКА. 2. Трехсосудистое поражение КА (ПМЖВ, ОВ и ПКА). 3. Сужение просвета венечных артерий на 70% и больше (особенно окклюзия КА). 4. Слабое развитие коллатерального кровообращения.
|
Левая вентрикулография
Селективная ангиокардиография ЛЖ(левая вентрикулография) является частью протокола инвазивного исследования больных ИБС, направляемых на операцию реваскуляризации миокарда. Она дополняет результаты КАГ и позволяет провести количественную оценку органических и функциональных нарушений ЛЖ. С помощью левой вентрикулографии можно:
- обнаружить региональные нарушения функции ЛЖ в виде локальных ограниченных участков акинезии, гипокинезии и дискинезии;
- диагностировать аневризму ЛЖ и оценить ее локализацию и размеры;
- выявить внутриполостные образования (пристеночные тромбы и опухоли);
- объективно оценить систолическую функцию ЛЖ на основании инвазивного определения важнейших гемодинамических показателей (ФВ, КСО, КДО, УО, МО, СИ, УИ, среднюю скорость кругового укорочения волокон и т.д.);
- оценить состояние клапанного аппарата сердца, в том числе врожденные и приобретенные патологические изменения аортального и митрального клапанов, которые могут повлиять на результаты хирургической реваскуляризации миокарда.
Локальные нарушения сократимости ЛЖявляются важным признаком очагового поражения миокарда, наиболее характерного для ИБС. Для выявления асинергий ЛЖ вентрикулограммы регистрируют во время систолы и диастолы, количественно оценивая амплитуду и характер движения стенки различных сегментов ЛЖ. На рис. 5.42 показан пример локального нарушения сократимости желудочка у больного ИБС. Наиболее частыми причинами “асинергий” ЛЖ у больных стабильной стенокардией напряжения являются рубцовые изменения сердечной мышцы после перенесенного ИМ, а также выраженная ишемия миокарда, в том числе “гибернирующий” и “оглушенный” миокард.
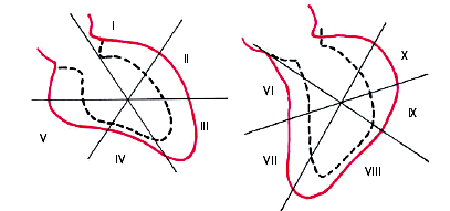
|
| Рис. 5.42. Схематическое изображение левой вентрикулограммы, зарегистрированной у больного ИБС. Красным цветом показан контур полости левого желудочка во время диастолы, пунктиром — во время систолы. Определяется гипокинезия нижнего сегмента. I–II — переднебоковой сегмент, III — верхушечный, IV–V нижний, VI–VII — переднесептальный, VIII — нижний, IХ–Х — задний сегменты левого желудочка |
Для расчета гемодинамических показателей проводят количественную обработку изображений полости левого желудочка, зарегистрированных в одной из проекций в конце систолы и диастолы. Методика расчета подробно описана в главе 6.
| 5.4.4. Лечение |

|
Лечение больных со стабильной стенокардией напряжения должно быть направлено на:
1. Устранение или уменьшение симптомов заболевания, в первую очередь, приступов стенокардии.
2. Повышение толерантности к физической нагрузке.
3. Улучшение прогноза заболевания и предупреждение возникновения нестабильной стенокардии, ИМ и внезапной смерти.
Для достижения этих целей применяется комплекс лечебно-профилактических мероприятий, включающий немедикаментозное, медикаментозное и, при необходимости, хирургическое лечение и предусматривающий активное воздействие на основные звенья патогенеза ИБС:
- антитромбоцитарная терапия (профилактика агрегации тромбоцитов и пристеночного тромбообразования);
- антиангинальные (антиишемические) ЛС (нитраты и молсидомин, b-адреноблокаторы, блокаторы медленных кальциевых каналов и др.);
- применение цитопротекторов;
- лечение и профилактика прогрессирования дисфункции ЛЖ;
- медикаментозная и немедикаментозная коррекция основных ФР ИБС (ГЛП, АГ, курения, ожирения, нарушений углеводного обмена и др.);
- при необходимости — лечение и профилактика нарушений ритма и проводимости;
- радикальное хирургическое устранение обструкции КА (реваскуляризация миокарда).
В настоящее время доказано положительное влияние большинства из перечисленных направлений и способов лечения на прогноз ИБС и частоту возникновения нестабильной стенокардии, ИМ и внезапной смерти.
Антитромбоцитарная терапия
Антитромбоцитарная терапия проводится с целью профилактики “обострений” ИБС, а также возникновения нестабильной стенокардии и ИМ. Она направлена на предотвращение пристеночного тромбообразования и, в известной степени, на сохранение целостности фиброзной оболочки атеросклеротической бляшки.
Выше неоднократно упоминалось о том, что в основе “обострений” ИБС и возникновения нестабильной стенокардии (НС) или ИМ лежит разрыв атеросклеротической бляшки в КА с формированием на ее поверхности вначале тромбоцитарного (“белого”), а затем фибринного (“красного”) пристеночного тромба. Начальный этап этого процесса, связанный с адгезией и агрегацией тромбоцитов, подробно описан в разделе 5.2. Упрощенная схема этого процесса, протекающего на поверхности атеросклеротической бляшки, представлена на рис. 5.43.
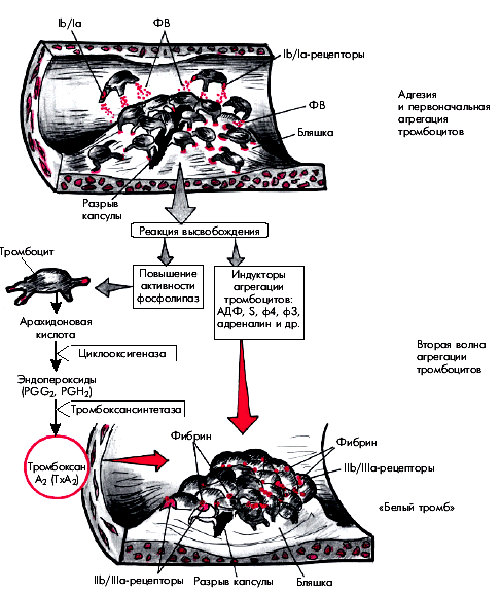
|
| Рис. 5.43. Упрощенная схема образования тромбоцитарного сгустка в области «осложненной» атеросклеротической бляшки. Фактор Виллебранда. Объяснение в тексте |
Напомним, что в результате разрыва атеросклеротической бляшки обнажаются субэндотелиальные тканевые структуры и липидное ядро бляшек, содержимое которого попадает на поверхность разрыва и в просвет сосуда. Обнажившиеся компоненты соединительнотканного матрикса (коллаген, фактор Виллебранда, фибронектин, лиминин, витронектин и др.), а также детрит липидного ядра, содержащий тканевой тромбопластин, активируют тромбоциты. Последние с помощью гликопротеидных рецепторов (Iа, Ib), расположенных на поверхности тромбоцитов, и фактора Виллебранда прилипают (адгезируют) к поверхности поврежденной бляшки, образуя здесь монослой тромбоцитов, рыхло связанных с поврежденным эндотелием.
Активированные и изменившие свою форму тромбоциты высвобождают индукторы последующей взрывной самоускоряющейся агрегации: АДФ, серотонин, фактор 3 и фактор 4 тромбоцитов, тромбоксан, адреналин и др. (“реакция высвобождения”). Одновременно активируется метаболизм арахидоновой кислоты и при участии ферментов циклооксигеназы и тромбоксансинтетазы образуется тромбоксан А2, который также обладает мощным агрегирующим, а также вазоконстрикторным действием.
В результате возникает вторая волна агрегации тромбоцитов и образуется тромбоцитарный агрегат (“белый” тромб). Следует помнить, что в процессе этой стадии агрегации тромбоциты плотно связываются друг с другом с помощью молекул фибриногена, которые, взаимодействуя с рецепторами IIb/IIIа тромбоцитов, плотно “сшивают” кровяные пластинки между собой. Одновременно с помощью фактора Виллебранда тромбоциты прикрепляются к подлежащему субэндотелию.
В дальнейшем активируется система коагуляции гемостаза и образуется фибринный тромб (см. главу 6).
Таким образом, адгезия и агрегация тромбоцитов — это первый начальный этап тромбообразования, важнейшими звеньями которого являются:
- функционирование специфических рецепторов тромбоцитов (Iа, Ib, IIb/IIIа и др.), обеспечивающих адгезию и окончательную агрегацию кровяных пластинок, и
- активация метаболизма арахидоновой кислоты.
Как известно, арахидоновая кислота входит в состав клеточных мембран тромбоцитов и сосудистого эндотелия. Под действием фермента циклооксигеназы она переходит в эндопероксиды. В дальнейшем в тромбоцитах под действием тромбоксансинтетазы эндопероксиды превращаются в тромбоксан А2, являющийся мощным индуктором дальнейшей агрегации тромбоцитов и одновременно обладающий вазоконстрикторным действием (рис. 5.44).
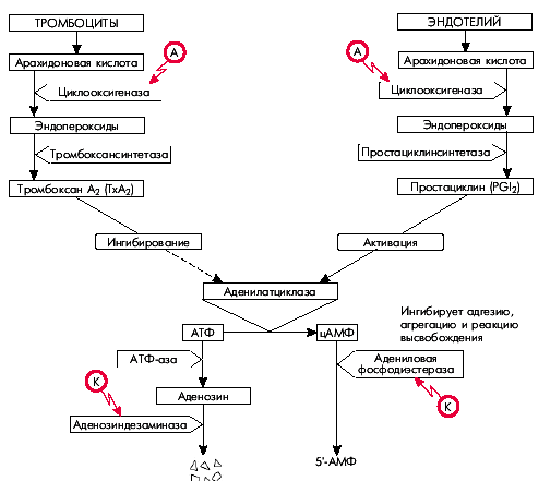
|
| Рис. 5.44. Схема метаболизма арахидоновой кислоты и механизм действия аспирина (А) и курантила (К). Красными стрелками оьозначено ингибирование антиагрегантами соответствующих превращений |
В сосудистом эндотелии пероксиды превращаются в простациклин, отличающийся противоположными эффектами: он ингибирует агрегацию тромбоцитов и обладает дилатирующими свойствами.
Действие тромбоксана А2 (ТхА2) и простациклина на агрегацию тромбоцитов реализуется благодаря их различному влиянию на аденилатциклазу, под действием которой АТФ превращается в цАМФ: тромбоксан А2 ингибирует это превращение, а простациклин — активирует. Следует помнить, что высокие концентрации цАМФ угнетают агрегацию тромбоцитов, тогда как уменьшение концентрации, наоборот, способствует агрегации. Именно поэтому простациклин, активирующий аденилатциклазу и увеличивающий содержание цАМФ, ингибирует адгезию, агрегацию и реакцию высвобождения тромбоцитов, а тромбоксан А2, наоборот, угнетая аденилатциклазу, замедляет переход АТФ в цАМФ. В результате уменьшается концентрация цАМФ, что способствует усилению адгезии и агрегации тромбоцитов.
С практической точки зрения большое значение имеют также дальнейшие превращения цАМФ и АТФ (см. рис. 5.44): цАМФ инактивируется (уменьшая свою концентрацию в клетке) адениловой фосфодиэстеразой. АТФ “распадается” под действием АТФ-азы на фосфорную кислоту и аденозин, инактивация которых осуществляется под действием аденозиндезаминазы. При увеличении активности адениловой фосфодиэстеразы уменьшается концентрация цАМФ, что способствует агрегации тромбоцитов. Активация аденозиндезаминазы приводит к снижению концентрации аденозина и преобладанию вазоконстрикторных эффектов.
 Запомните
1. Метаболизм арахидоновой кислоты регулируется ферментом циклооксигеназой, под действием которой арахидоновая кислота трансформируется в эндопероксиды. 2. Дальнейший метаболизм арахидоновой кислоты в тромбоцитах и сосудистом эндотелии имеет разные следствия: в тромбоцитах эндопероксиды превращаются в тромбоксан А2, являющийся мощным индуктором дальнейшей агрегации тромбоцитов и одновременно обладающий вазоконстрикторным действием, а в сосудистом эндотелии пероксиды превращаются в простациклин, отличающийся противоположными эффектами: он ингибирует агрегацию тромбоцитов и обладает дилатирующими свойствами. 3. Действие тромбоксана А2 (ТхА2) и простациклина на агрегацию тромбоцитов реализуется благодаря их различному влиянию на аденилатциклазу, под действием которой АТФ превращается в цАМФ, высокие концентрации которого угнетают агрегацию тромбоцитов, тогда как снижение концентрации цАМФ, наоборот, способствует агрегации. 4. Адениловая фосфодиэстераза инактивирует цАМФ, аденозиндезаминаза инактивирует аденозин. При увеличении активности адениловой фосфодиэстеразы уменьшается концентрация цАМФ, что способствует агрегации тромбоцитов. Активация аденозиндезаминазы приводит к снижению концентрации аденозина и преобладанию вазоконстрикторных эффектов. Запомните
1. Метаболизм арахидоновой кислоты регулируется ферментом циклооксигеназой, под действием которой арахидоновая кислота трансформируется в эндопероксиды. 2. Дальнейший метаболизм арахидоновой кислоты в тромбоцитах и сосудистом эндотелии имеет разные следствия: в тромбоцитах эндопероксиды превращаются в тромбоксан А2, являющийся мощным индуктором дальнейшей агрегации тромбоцитов и одновременно обладающий вазоконстрикторным действием, а в сосудистом эндотелии пероксиды превращаются в простациклин, отличающийся противоположными эффектами: он ингибирует агрегацию тромбоцитов и обладает дилатирующими свойствами. 3. Действие тромбоксана А2 (ТхА2) и простациклина на агрегацию тромбоцитов реализуется благодаря их различному влиянию на аденилатциклазу, под действием которой АТФ превращается в цАМФ, высокие концентрации которого угнетают агрегацию тромбоцитов, тогда как снижение концентрации цАМФ, наоборот, способствует агрегации. 4. Адениловая фосфодиэстераза инактивирует цАМФ, аденозиндезаминаза инактивирует аденозин. При увеличении активности адениловой фосфодиэстеразы уменьшается концентрация цАМФ, что способствует агрегации тромбоцитов. Активация аденозиндезаминазы приводит к снижению концентрации аденозина и преобладанию вазоконстрикторных эффектов.
|
Описанные схемы тромбоцитарно-сосудистого гемостаза, а также метаболизма арахидоновой кислоты следует учитывать при назначении тех или иных ЛС, обладающих антитромбоцитарным эффектом. В настоящее время наиболее широкое распространение в клинической практике получили следующие антитромбоцитарные препараты:
- аспирин (ацетилсалициловая кислота);
- тиклопидин (тиклид);
- клопридогел;
- курантил (дипиридамол).
Аспирин (ацетилсалициловая кислота)
Более 20 лет аспирин является одним из основных ЛС для лечения и профилактики ИБС. Механизм антиагрегантного действия аспирина обусловлен ингибированием фермента циклооксигеназы (см. рис. 5.44). При этом следует иметь в виду, что ингибирование циклооксигеназы тромбоцитов сопровождается уменьшением образования тромбоксана А2 и, следовательно, уменьшением агрегации тромбоцитов и вазоконстрикторного действия тромбоксана. Наоборот, угнетение циклооксигеназы сосудистого эндотелия приводит к уменьшению образования простациклина, что способствует уменьшению его вазодилатирующего и антиагрегантного действия.
Важно помнить, что циклооксигеназа тромбоцитов чувствительна даже к малым дозам аспирина (75–325 мг в сутки), тогда как нежелательное угнетение образования простациклина происходит только при сравнительно высоких суточных дозах этого ЛС. Поэтому больным ИБС рекомендуют обычно прием малых доз препарата, не превышающих 75–325 мг в сутки. Действие аспирина на циклооксигеназу тромбоцитов необратимо и эффект препарата сохраняется на протяжении всей жизни тромбоцита, т.е. в течение 8–10 дней.
По данным международного многоцентрового широкомасштабного исследования (Second International Study of Infarct Survival, ISIS-2, 1990), применение аспирина снижало летальность больных от сердечно-сосудистых причин на 23% по сравнению с плацебо. Применение аспирина у больных ИБС и АГ уменьшало частоту летальных и нелетальных ИМ на 36%, а летальность от коронарных осложнений — на 15% (широкомасштабное исследование Hypertension Optimal Treatment, HOT, включавшее 26 000 пациентов).
Характерно, что эффективность малых (менее 160 мг в сутки), средних (160–325 мг в сутки) и высоких (500–1500 мг в сутки) доз аспирина оказалась примерно одинаковой. Это позволяет рекомендовать аспирин в суточной дозе 160–325 мг в сутки для лечения больных ИБС. Обычно используют дозы 100–325 мг в сутки. Более высокие дозы препарата угнетают выработку простациклина и приводят к росту числа побочных эффектов. Лечение аспирином должно проводиться длительно (практически в течение всей жизни больного).
Побочные эффекты. При использовании малых доз препарата серьезные побочные эффекты, требующие отмены препарата, развиваются сравнительно редко. В то же время следует учитывать возможность возникновения следующих нежелательных явлений:
- небольшие болевые ощущения в эпигастрии (примерно в 20–30% случаев при длительном применении);
- диспептические явления: тошнота, диарея, изредка рвота;
- желудочно-кишечные и другие кровотечения (в 5–8% случаев при длительном приеме);
- бронхоспазм;
- гиперчувствительность к препарату.
Риск возникновения побочных эффектов при приеме аспирина можно уменьшить, если использовать минимальные дозы препарата или его новые лекарственные формы (напpимер, аспирин-кардио).
Противопоказания. Назначение аспирина противопоказано в следующих случаях:
- при обострении язвенной болезни желудка и двенадцатиперстной кишки;
- при геморрагическом диатезе;
- в возрасте до 12 лет;
- при беременности (последний триместр);
- при повышенной чувствительности к салицилатам.
С осторожностью следует применять аспирин у больных, страдающих бронхиальной астмой, при неконтролируемой АГ, при одновременной терапии антикоагулянтами, при наличии язвенной болезни желудка и двенадцатиперстной кишки в анамнезе, в первом и втором триместрах беременности.
Тиклопидин
Тиклопидин (тиклид) является производным тиенопиридина и обладает отчетливыми антитромбоцитарными свойствами. Под действием тиклопидина блокируются АДФ-рецепторы тромбоцитов, подавляется адгезия кровяных пластинок, а также уменьшается связывание фибриногена с IIb/IIIа рецепторами тромбоцитов на заключительном этапе агрегации (см. рис. 5.43). Хотя эффект тиклопидина сопоставим с таковым аспирина, а по некоторым данным (исследования CATS и TASS) превышает его, он редко применяется для длительного лечения больных ИБС, в частности, в связи с возможными побочными явлениями в виде развития нейтропении, панцитопении и повышения содержания ЛНП и ЛОНП. Тиклопидин используют, в основном, в кардиохирургической практике в виде коротких (до 1–2 месяцев) курсов антитромбоцитарной терапии после операции аортокоронарного шунтирования или чрескожной транслюминальной баллонной ангиоплатстики. Препарат назначают в дозе 500 мг в сутки в 2 приема. Терапевтический эффект наступает только через 3–5 дней после начала лечения и сохраняется в течение10 дней после отмены препарата.
При применении тиклопидина необходим контроль анализа крови каждые 2 недели, по крайней мере, в течение первых 3-х месяцев лечения.
Дата добавления: 2016-01-20; просмотров: 556;
