Ультразвуковая допплерография артерий нижних конечностей 4 страница
| Рис. 5.10. Участие специфических IIb/IIIа - рецепторов тромбоцитов и фибриногена в формировании пристеночного тромбоцитарного сгустка. Кружочки красного цвета — фибриноген | 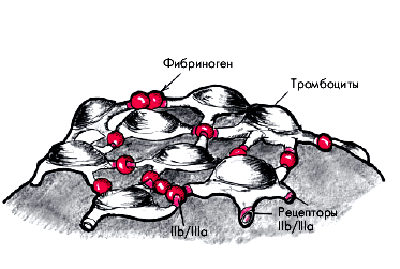
|
 Запомните
Наиболее важными факторами, обеспечивающими первичный сосудисто-тромбоцитарный гемостаз, являются: 1. Число тромбоцитов в крови. 2. Фактор Виллебранда (VIII фактор свертывания), способствующий адгезии и агрегации тромбоцитов. 3. Наличие в мембранах тромбоцитов специфического рецептора (гликопротеина Ib), обеспечивающего вместе с фактором Виллебранда адгезию пластинок к коллагеновым волокнам поврежденного сосуда. 4. Наличие в мембранах активированных тромбоцитов рецепторов (гликопротеины IIb и IIIа), вступающих в специфическую реакцию с фибриногеном, которая имеет значение в формировании необратимой агрегации пластинок. 5. Нормальный синтез в тромбоцитах из арахидоновой кислоты тромбоксана А2 и простациклина. Запомните
Наиболее важными факторами, обеспечивающими первичный сосудисто-тромбоцитарный гемостаз, являются: 1. Число тромбоцитов в крови. 2. Фактор Виллебранда (VIII фактор свертывания), способствующий адгезии и агрегации тромбоцитов. 3. Наличие в мембранах тромбоцитов специфического рецептора (гликопротеина Ib), обеспечивающего вместе с фактором Виллебранда адгезию пластинок к коллагеновым волокнам поврежденного сосуда. 4. Наличие в мембранах активированных тромбоцитов рецепторов (гликопротеины IIb и IIIа), вступающих в специфическую реакцию с фибриногеном, которая имеет значение в формировании необратимой агрегации пластинок. 5. Нормальный синтез в тромбоцитах из арахидоновой кислоты тромбоксана А2 и простациклина.
|
У больных коронарным атеросклерозом активация тромбоцитарно-сосудистого гемостаза выполняет роль важнейшего механизма возникновения коронарной недостаточности. Причиной этого служат многочисленные дефекты эндотелиального покрова, особенно в области атероматозных бляшек. Это ведет к обнажению субэндотелиальных структур — коллагеновых волокон, гладкомышечных клеток.
Таким образом, у больных ИБС активация тромбоцитарного гемостаза может приводить к образованию, по меньшей мере, пристеночного тромба, а также эмболизации дистально расположенных венечных сосудов отслоившимися фрагментами тромба и атероматозной бляшки. Особенно часто такая ситуация складывается у больных с так называемой нестабильной стенокардией и острым ИМ (см. ниже).
Микроваскулярная дисфункция
Микроваскулярная дисфункция — еще один важный механизм нарушения коронарного кровотока, который, в частности, лежит в основе возникновения особой формы ИБС — микроваскулярной стенокардии (“синдрома Х”).
Микроваскулярная дисфункция характеризуется: 1) отсутствием типичных атеросклеротических изменений крупных (эпикардиальных) КА и 2) наличием выраженных функциональных и морфологических расстройств дистально расположенных КА. Основные изменения происходят на уровне мелких КА — преартериол, размер которых не превышает 150–350 мкм. Они характеризуются значительным сужением просвета мелких КА за счет гипертрофии и гиперплазии гладкомышечных клеток медии и фибропластических процессов в ней (Masery с соавт.) (рис. 5.11). В результате в различных участках миокарда происходит неодинаковое сужение преартериол и, главное, снижается их способность расширяться при увеличении потребности миокарда в кислороде.
| Рис. 5.11. Морфологические изменения в стенке мелких артерий при микроваскулярной дисфункции (б); а — норма | 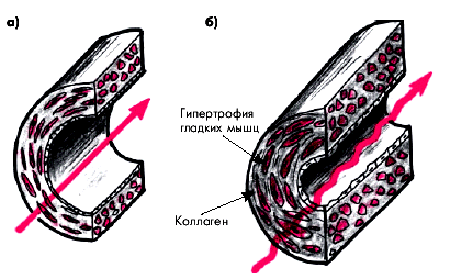
|
Предполагают, что в основе этих изменений лежит выраженная дисфункция эндотелия, в частности, повышенная продукция вазоконстрикторных субстанций — эндотелина и нейропептида Y. Одновременно снижается продукция оксида азота (NО), простациклина и других вазодилатирующих субстанций. В результате развивается выраженный спазм преартериол и появляются участки преходящей ишемии сердечной мышцы. Компенсаторно происходит расширение более дистально расположенных и сравнительно интактных артериол, что в условиях неравномерного поражения коронарного русла сопровождается развитием синдрома межкоронарного обкрадывания, который способствует еще большему усугубления ишемии.
Кроме того, возникновению описанных дисфункций микроциркуляторного сосудистого русла способствуют повышение агрегации тромбоцитов и ухудшение реологических свойств крови.
| 5.2.2. Последствия ишемического повреждения миокарда |

|
Снижение кровоснабжения миокарда и развитие ишемических повреждений ЛЖ (ишемия, дистрофия, некроз) приводят к формированию многочисленных функциональных и морфологических нарушений в сердечной мышце, которые во многом определяют клиническую картину заболевания и его прогноз. К числу наиболее значимых последствий ИБС относятся:
- снижение энергетического обеспечения кардиомиоцитов;
- гибернирующий (“спящий”) и “оглушенный” миокард;
- кардиосклероз (диффузный атеросклеротический и очаговый постинфарктный);
- диастолическая и систолическая дисфункция ЛЖ;
- нарушения ритма и проводимости и др.
Снижение энергетического обеспечения кардиомиоцитов
В норме в присутствии достаточного количества кислорода энергетические потребности кардиомиоцитов удовлетворяются, как известно, за счет нелимитированного окисления жирных кислот и глюкозы. В результате образуются высокоэнергетические фосфаты — аденозинтрифосфат (АТФ) и креатинфосфат (КФ), которые используются на обеспечение механической, электрической и других функций кардиомиоцита.
Снижение коронарного кровотока создает дефицит кислорода в миокарде, и пораженные клетки переходят на гораздо менее эффективный, анаэробный, путь метаболизма. При этом нарушается процесс окислительного фосфорилирования, активируется менее эффективное окисление ЖК, глюкоза превращается в лактат, снижается рН клетки, уменьшается содержание внутриклеточного К+ и выработка макроэргических соединений. Это ведет к прогрессирующему снижению электрической активности клетки, в том числе к уменьшению амплитуды и продолжительности ТМПД, нарушению проведения электрического импульса и снижению механической функции миокарда (рис. 5.12). В результате возникает нарушение локальной сократимости ишемизированных сегментов ЛЖ (гипокинезия).
| Рис. 5.12. Изменение электрической активности (ТМПД) в ишемизированной зоне (обозначена красным уветом) | 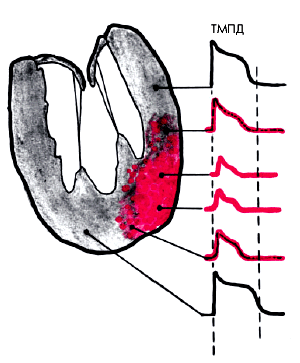
|
При полном прекращении коронарного кровотока развивается некроз кардиомиоцитов, и они погибают. В некротизированном участке миокарда полностью отсутствует электрическая активность, здесь не проводится электрический импульс, прекращается механическая активность (акинезия миокарда).
Гибернирующий (“спящий”) и “оглушенный” миокард
Выраженное хроническое нарушение коронарного кровотока не всегда приводит к гибели кардиомиоцитов. В некоторых случаях можно наблюдать (в том числе в клинике, с помощью современных неинвазивных инструментальных методов исследования) две своеобразные реакции миокарда на длительное существование нарушений коронарного кровотока.
1.Феномен гибернации (“спячки”) миокарда, находящегося в условиях хронического уменьшения коронарной перфузии.
2. Феномен “оглушения”, выявляющийся после восстановления исходной перфузии тканей (реперфузии).
Гибернация миокарда (hybernatio, “спячка”) — это нарушение локальной сократимости ЛЖ, возникающее при выраженном и продолжительном снижении его перфузии, не сопровождающемся иными признаками ишемии. Феномен гибернации является своеобразной формой клеточного анабиоза, обеспечивающего выживаемость кардиомиоцитов в условиях дефицита кислорода. Глубокие метаболические сдвиги, происходящие при гипоксии (дефицит макроэргических соединений, накопление в клетках ионов Н+ и выход из клеток аденозина и ионов К+ и др.), как бы вынуждают кардиомиоциты резко ограничить расход энергии и, соответственно, сократительную функцию. Возникает неустойчивое равновесие между сниженной перфузией и сниженной сократимостью. При этом миокард в течение более или менее длительного времени сохраняет способность почти полностью восстанавливать свою прежнюю сократительную функцию, если произойдет нормализация коронарного кровотока (успешный тромболизис, реваскуляризация). Однако дальнейшее снижение перфузии или увеличение потребности миокарда в кислороде приводит к развитию ишемии, а затем и некроза.
Гибернирующий миокард реагирует на введение катехоламинов: например, под влиянием малых доз добутамина временно восстанавливается сократимость миокарда, что доказывает его жизнеспособность.
Феномен “оглушенного” миокарда (stunning) — это преходящее постишемическое нарушение локальной сократимости ЛЖ, возникающее после восстановления исходного коронарного кровообращения (реперфузии) и прекращения действия ишемии. В “оглушенном” миокарде, пережившем период длительной ишемии, энергетические ресурсы и сократительная функция отдельных кардиомиоцитов восстанавливаются медленно, в течение нескольких дней. Несмотря на отсутствие повреждения клеток, сократимость миокарда в течение некоторого времени остается нарушенной.
Феномены гибернирующего и “оглушенного” миокарда очень характерны для больных с “обострением” ИБС, например у пациентов с нестабильной стенокардией, хотя встречаются и при стабильном течении заболевания (см. ниже).
Кардиосклероз
Хроническое нарушение перфузии миокарда и снижение его метаболизма закономерно сопровождаются уменьшением количества кардиомиоцитов, замещением их вновь образующейся соединительной тканью, а также развитием компенсаторной гипертрофии сохранившихся мышечных волокон. Совокупность этих морфологических изменений вместе с признаками ишемических повреждений миокарда (участков дистрофии миокарда и микронекрозов) в отечественной литературе традиционно описывается как диффузный атеросклеротический кардиосклероз (рис. 5.13, а). Клинически он проявляется, в основном, признаками систолической и диастолической дисфункции ЛЖ, медленно прогрессирующей ХСН, а также часто развивающимися нарушениями сердечного ритма и внутрижелудочковой проводимости (блокады ножек и ветвей пучка Гиса). Атеросклеротический кардиосклероз, как правило, сопутствует другим формам ИБС и в современной международной классификации ИБС (см. ниже) не выделяется в качестве самостоятельной формы этого заболевания. Тем не менее он значительно усугубляет течение заболевания.
В практическом отношении важно помнить, что диффузное разрастание соединительной ткани в сердечной мышце, по крайней мере, частично является следствием повышения активности САС, тканевых РАС, ангиотензина II, альдостерона и других веществ, которые способствуют новообразованию коллагена.
У больных ИМ в результате организации зоны некроза в сердце образуются крупные рубцовые поля, являющиеся морфологической основой постинфарктного кардиосклероза (рис. 5.13, б). Последний существенно осложняет течение ИБС, прежде всего за счет прогрессирования ХСН и возникновения желудочковых аритмий высоких градаций. Весьма неблагоприятным следствием постинфарктного кардиосклероза является хроническая аневризма ЛЖ (рис. 5.14) — мешковидное локальное выбухание, которое, как правило, резко изменяет характер дальнейшего течения ИБС и во многом определяет прогноз заболевания и судьбу больного.
| Рис. 5.13. диффузный (а) и очаговый (б) кардиосклероз | 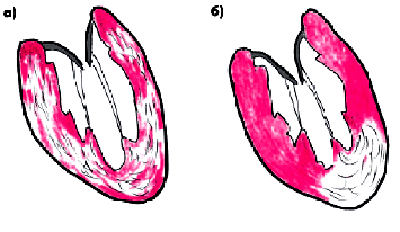
|
| Рис. 5.14. Схематическое изображение аневризмы левого желудочка | 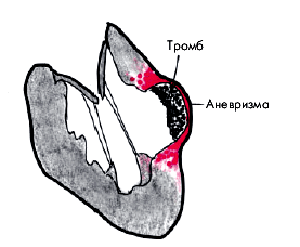
|
Дисфункция левого желудочка
Дисфункция ЛЖ — один из характерных признаков, присущих многим клиническим формам ИБС. Самым ранним функциональным нарушением сердечной мышцы при ИБС является диастолическая дисфункция ЛЖ, которая обусловлена:
- увеличением ригидности сердечной мышцы за счет ишемии миокарда, наличия атеросклеротического и постинфарктного кардиосклероза, а также компенсаторной гипертрофии миокарда ЛЖ;
- существенным замедлением процесса активного диастолического расслабления в результате нарушения обратного транспорта Са2+ в саркоплазматический ретикулум и внеклеточную среду.
Систолическая дисфункция ЛЖ развивается, как правило, при выраженном дефиците макроэргических соединений и обусловлена нарушением актин-миозинового взаимодействия и доставки Са2+ к сократительным белкам вследствие повреждения ионных насосов и истощения запасов макроэргических соединений (Е.Н. Амосова).
Нарушения ритма и проводимости
Внутрижелудочковые и АВ-блокады развиваются у больных ИБС, главным образом, вследствие диффузного и очагового кардиосклероза, а также хронического нарушения кровоснабжения АВ-узла и проводящей системы сердца.
В основе желудочковых и суправентрикулярных нарушений ритма лежит выраженная электрическая негомогенность сердечной мышцы, отдельные участки которой отличаются по своим электрофизиологическим свойствам, в частности, по продолжительности эффективных рефрактерных периодов, общей длительности реполяризации, по скорости проведения электрического импульса, что способствует возникновению ранних и поздних деполяризаций и формированию повторного входа волны возбуждения (re-entry). Желудочковые аритмии высоких градаций (желудочковая тахикардия и фибрилляция желудочков), а также фатальные нарушения проводимости (АВ-блокада III степени, асистолия желудочков и т.п.) являются наиболее частыми причинами внезапной сердечной смерти у больных ИБС.
 Запомните
Наиболее значимыми последствиями ишемического поражения сердечной мышцы у больных ИБС являются: 1. Нарушения энергетического обеспечения кардиомиоцитов, сопровождающиеся локальным снижением их электрической и механической активности. 2. Появление в сердечной мышце участков гибернирующего (“спящего”) и “оглушенного” миокарда. 3. Диффузный атеросклеротический и очаговый постинфарктный кардиосклероз с формированием в некоторых случаях хронической аневризмы ЛЖ. 4. Прогрессирующая систолическая и диастолическая дисфункция ЛЖ. 5. Нарушения ритма и проводимости. Запомните
Наиболее значимыми последствиями ишемического поражения сердечной мышцы у больных ИБС являются: 1. Нарушения энергетического обеспечения кардиомиоцитов, сопровождающиеся локальным снижением их электрической и механической активности. 2. Появление в сердечной мышце участков гибернирующего (“спящего”) и “оглушенного” миокарда. 3. Диффузный атеросклеротический и очаговый постинфарктный кардиосклероз с формированием в некоторых случаях хронической аневризмы ЛЖ. 4. Прогрессирующая систолическая и диастолическая дисфункция ЛЖ. 5. Нарушения ритма и проводимости.
| ||
| 5.3. Классификация ИБС | ||

| ||
Многообразие механизмов, определяющих характер и скорость развития и прогрессирования ИБС, объясняет существование многочисленных вариантов клинических проявлений этого заболевания, главными из которых являются внезапная сердечная смерть (ВСС), стенокардия, безболевая ишемия миокарда (БИМ), инфаркт миокарда (ИМ) и постинфарктный кардиосклероз.
К сожалению, до сих пор общепринятой клинической классификации ИБС не существует. Это связано, прежде всего, с быстро меняющимися представлениями о механизмах развития коронарной недостаточности, с наличием общего морфологического субстрата различных форм ИБС и возможностью быстрого и часто непредсказуемого перехода одной клинической формы этого заболевания в другую, а также с существованием у одного и того же больного сразу нескольких форм ИБС (например, постинфарктного кардиосклероза, стенокардии и безболевой ишемии миокарда).
Наибольшее распространение в нашей стране получила классификация ВКНЦ АМН СССР (1984), разработанная на основе рекомендаций экспертов ВОЗ (1979).
Дата добавления: 2016-01-20; просмотров: 630;
