Поверхностное натяжение.
Реальные газы
Условия идеальности не выполняются при высоких давлениях (выше ~10 атм) и низких температурах, необходимо учитывать взаимодействие молекул и их собственный объем.
Силы взаимодействия молекул являются электростатическими.
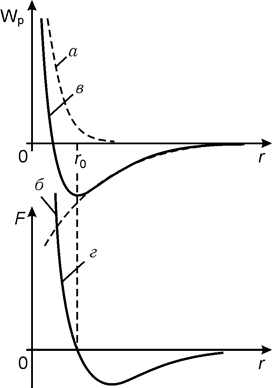
При  , сила
, сила  - сила притяжения, при
- сила притяжения, при  это сила отталкивания. При
это сила отталкивания. При  сила взаимодействия молекул равна нулю.
сила взаимодействия молекул равна нулю.
Экспериментальные изотермы реального газа:
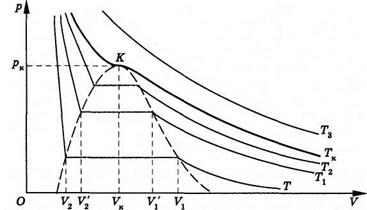
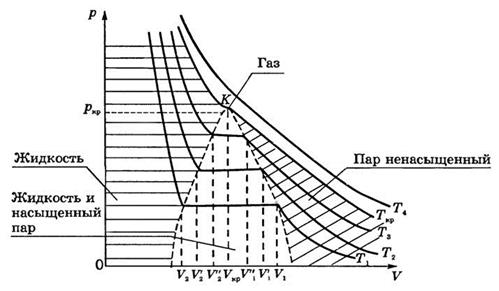
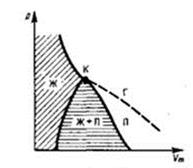
Точка К – критическая точка,в ней параметрысостояния жидкости и пара совпадают (отсутствует граница между жидкостью и паром). Точка К является точкой перегиба изотермы  .
.
 - критическая температура(максимальная температура, при которой еще возможно существование вещества в жидком состоянии). При температурах
- критическая температура(максимальная температура, при которой еще возможно существование вещества в жидком состоянии). При температурах 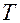 >
>  газ невозможно изотермическим сжатием перевести в жидкое состояние, кинетическая энергия молекул превышает потенциальную энергию притяжения.
газ невозможно изотермическим сжатием перевести в жидкое состояние, кинетическая энергия молекул превышает потенциальную энергию притяжения.
| газ |  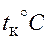
|
| гелий | -263◦С |
| водород | -240◦С |
| азот | -146◦С |
| кислород | -118◦С |
| водяной пар | 374◦С |
Газ при температуре ниже критической, который можно превратить в жидкость изотермическим сжатием, называется паром. Пар, находящийся в равновесии с жидкостью, называют насыщенным.
Универсального уравнения, описывающего состояние реального газа, не существует.
Одно из приближенных ур-й - ур-е Ван-дер-Ваальса:
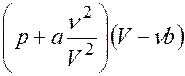 =
= 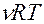 .
.
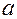 - поправка, учитывающая взаимное притяжение молекул (давление реального газа меньше давления идеального),
- поправка, учитывающая взаимное притяжение молекул (давление реального газа меньше давления идеального),
 - поправка, учитывающая собственный объем молекул.
- поправка, учитывающая собственный объем молекул.
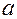 и
и  определяются экспериментально.
определяются экспериментально.
Критические давление, объем и температура:
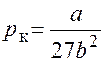 ,
,  ,
, 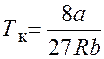 .
.
Идеальный газ при адиабатическом расширении всегда охлаждается. Реальные газы в зависимости от начальных условий могут как охлаждаться, так и нагреваться. Причиной является то, что внутренняя энергия реального газа, кроме кинетической энергии теплового движения молекул, включает также потенциальную энергию их взаимодействия.
ЖИДКОСТИ
В жидкостях молекулы колеблются около своих положений равновесия, при этом некоторые из них покидают свои места и занимают новое положение равновесия. С ростом температуры интенсивность такого движения увеличивается.
Молекула жидкости взаимодействует только с несколькими близко расположенными, т.к. силы взаимодействия молекул быстро уменьшаются с расстоянием (радиус действия ~ 10-9 м).
В жидкостях наблюдается «ближний» порядок в расположении молекул (их упорядоченное расположение сохраняется на малых расстояниях), в твердых телах – «дальний» порядок.
Поверхностное натяжение.
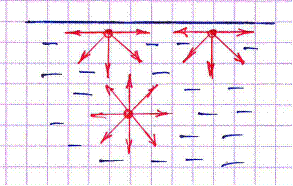
Силы, направленные внутрь жидкости, создают молекулярное (или внутреннее давление).
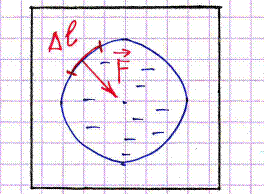
Силы, препятствующие разрыву поверхности жидкости, наз-тся силами поверхностного натяжения(рис.1).
Силы, действующие на молекулы в поверхностном слое, сокращают поверхность жидкости, стремясь придать ей форму сферы. Сфера имеет наименьшую поверхность при данном объеме.
Сила 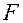 поверхностного натяжения:
поверхностного натяжения:
 ,
,
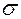 - коэффициент поверхностного натяжения,
- коэффициент поверхностного натяжения,
 - участок длины контура, ограничивающего поверхность жидкости.
- участок длины контура, ограничивающего поверхность жидкости.
Сила  направлена по касательной к этой поверхности жидкости, перпендикулярно участку
направлена по касательной к этой поверхности жидкости, перпендикулярно участку  контура (Рис.2).
контура (Рис.2).

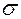 зависит от рода жидкости, температуры, примесей. (Мыло, спирт уменьшают
зависит от рода жидкости, температуры, примесей. (Мыло, спирт уменьшают 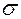 воды, соль увеличивает).
воды, соль увеличивает).
Вещ-ва, уменьшающие 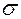 - поверхностно активные.
- поверхностно активные.

При сокращении поверхности работа силы натяжения:
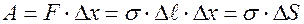 ,
,
 - изменение площади поверхности жидкости.
- изменение площади поверхности жидкости.
Т.к. 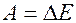 , то
, то
поверхностная потенциальная энергия жидкости
 ,
,
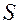 - величина поверхности жидкости.
- величина поверхности жидкости.
Дата добавления: 2016-01-20; просмотров: 929;
