ОСНОВЫ РАСЧЕТА ПРОЦЕССА МАССООБМЕНА
(АБСОРБЦИИ)
Рассмотрим процесс массообмена между газовой и жидкой фазами (рис. 5.1).
Рисунок 5.1 - Схема процесса массообмена между газом и жидкостью
Между газовой фазой Gи жидкой фазой Lимеется поверхность раздела. Пусть концентрация газового компонента в газовой среде будет больше, чем в жидкой. На некотором расстоянии от поверхности раздела фаз в каждой из фаз проходит интенсивная конвективная диффузия молекул, и можно считать, что концентрация газового компонента у во всех точках газовой фазы и концентрация этого же компонента х во всех точках жидкой фазы будут постоянными. В пограничных слоях с разных сторон поверхности раздела фаз движение молекул осуществляется как молекулярной, так и конвективной диффузией. Скорость конвективной диффузии значительно больше скорости молекулярной диффузии. Чем ближе к поверхности раздела фаз, тем меньше становится скорость конвективной диффузии и возрастает скорость молекулярной диффузий. Таким образом, для того чтобы газовый компонент растворился в жидкости, он должен из общей массы газовой смеси в результате конвективной диффузии подойти к пограничному слою, под влиянием молекулярной диффузии перейти поверхность раздела фаз и в результате конвективной диффузии проникнуть в жидкость.
В процессе перехода из газовой в жидкую фазу концентрация газового компонента постепенно уменьшается в газовой фазе и возрастает в жидкой. Переход газового компонента из газовой фазы в жидкую будет проходить до тех пор, пока концентрация его в этих двух фазах не станет равновесной. Следовательно, движущая сила процесса массообмена может быть выражена разностью концентраций газообразного компонента ун—yр=Δ в газовой фазе и хр—хн=Δ в жидкой фазе. Равновесная концентрация поглощаемого компонента yр в газовой фазе, которая характеризует окончание процесса массообмена, может быть определена из закона Генри по формуле

где Мк, Мсм - молекулярные массы соответственно газового компонента и смеси газа, в котором находится этот компонент, кг; 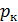 и
и 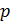 - парциальное давление газового компонента в смеси и общее давление газовой смеси, Н/м2.
- парциальное давление газового компонента в смеси и общее давление газовой смеси, Н/м2.
Движущая сила массообмена неодинакова на входе газа в аппарат и на выходе его из аппарата. Поэтому при расчете аппаратов для химической очистки газа в формулу (5.7) следует подставлять ее среднее значение. Если обозначить Δ1 движущую силу массообмена на входе газа в аппарат, а Δ2 - на выходе из аппарата, то в аппаратах, в которых между газом и жидкостью осуществлен принцип противотока, значение средней движущей силы массообмена будет при Δ1/Δ2>2:

При условии 0,5<Δ1/Δ2<2

В противоточных аппаратах газ перед выходом из аппарата соприкасается со свежей жидкостью, которая способна в большей мере поглощать определенный газообразный компонент, и в результате газ более полно очищается, чем в прямоточных аппаратах. Поэтому в противоточных аппаратах значение движущей силы массообмена (абсорбции) больше, чем в прямоточных.
Коэффициент массопередачи, определяющий скорость абсорбции, может быть представлен из уравнения (5.7) следующей формулой:

Таким образом, коэффициент массопередачи определяет количество газового компонента, который переходит из газовой среды в жидкую через единицу поверхности раздела (F=l) при Δср=1. Для определения коэффициента массопередачи выразим уравнение конвентивного массообмена между газовой и жидкой фазами.
Количество газового компонента, которое перейдет из газовой фазы к поверхности раздела фаз, будет:

Количество газового компонента, которое перейдет от поверхности раздела фаз в жидкость:

где 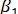 ,
, 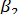 - коэффициенты массоотдачи соответственно для газовой и жидкой фаз, м/с. Представим, что линия равновесия фаз будет прямой с тангенсом угла наклона m. Ее уравнение имеет вид
- коэффициенты массоотдачи соответственно для газовой и жидкой фаз, м/с. Представим, что линия равновесия фаз будет прямой с тангенсом угла наклона m. Ее уравнение имеет вид
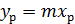
Из этого уравнения выразим концентрацию компонента в жидкой фазе через его концентрацию в газовой фазе:
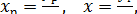
где уг - концентрация компонента в газовой фазе, равновесная с его концентрацией в общей массе жидкой фазы.
Подставив эти значения в уравнение (5.13) и сделав преобразования в уравнениях (5.12) и (5.13), получим
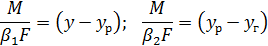
Сложив эти уравнения, получим выражение движущей силы абсорбции:

Обозначив выражение в скобках через 1/К, найдем выражение коэффициента массопередачи (абсорбции):

Член 1/ 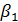 выражает сопротивление переходу газообразного компонента в газовой фазе, а член
выражает сопротивление переходу газообразного компонента в газовой фазе, а член 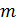 /
/  - в жидкой фазе. Для хорошо растворимых газов процесс абсорбции определяется в основном сопротивлением в газовой фазе; в этом случае сопротивление жидкой фазы мало и им можно пренебречь. При плохо растворимых газах можно пренебречь сопротивлением газовой фазы и учитывать только сопротивление жидкой фазы. Размерность коэффициента абсорбции К может быть получена из формулы (5.11) в зависимости от размерности движущей силы процесса абсорбции:
- в жидкой фазе. Для хорошо растворимых газов процесс абсорбции определяется в основном сопротивлением в газовой фазе; в этом случае сопротивление жидкой фазы мало и им можно пренебречь. При плохо растворимых газах можно пренебречь сопротивлением газовой фазы и учитывать только сопротивление жидкой фазы. Размерность коэффициента абсорбции К может быть получена из формулы (5.11) в зависимости от размерности движущей силы процесса абсорбции:

Если Δ выражена в единицах объема (кг/м3), то Кс будет выражен в кг/(м2·с·кг/м3) или м/с.
При выражении Δ через единицы давления (Н/м2) Kр будет иметь размерность кг/(м2·с·Н/м2) или с/м.
Если Δ выражена в массовых единицах (кг/кг), то
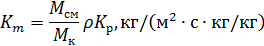
Связь между Кр и Кс выражается зависимостью
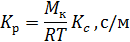
Коэффициент массоотдачи определяют по эмпирическим формулам, найденным опытным путем для различных процессов. По формулам (5.9), (5.10), (5.15) получают точные результаты для расчетов процесса абсорбции газов в случае, если линия равновесия является прямой. В других случаях расчет аппаратов осуществляют графо- аналитическим методом (расчетом числа единиц переноса).
Дата добавления: 2016-01-18; просмотров: 1468;
