ПОТЕНЦІОМЕТРИЧНИЙ МЕТОД
Потенціометричнийметод аналізу складу рідин використовується у двох напрямках:
- вимірювання кислих або лужних функцій розчину;
- визначення моменту нейтралізації розчину при їх титруванні.
Кислотні або лужні властивості розчинів визначається по активності в них іонів водню [Н+].
Суть явища визначається електролітичною дисоціацією і зв’язаною з нею теорією електродних потенціалів.
Дисоціація властива будь-якому розчину і пов’язана з утворенням в розчині електроіонів позитивних іонів (катіонів) і негативних іонів (аніонів). Більшість хімічних процесів відбувається в водних розчинів. Чиста вода являє собою нейтральну речовину,, якій властиві в рівній мірі і кислотні і лужні властивості. Вона слабо дисоціює з утвореннями катіонів водню [Н+] та аніонів гідроксилу [ОН-]: Н2О↔[Н+] + [ОН-].
Так як молекула води є досить сталою хімічною сполукою, то концентрація іонів водню і гідроксилу, порівняно з концентрацією її недисоційованих молекул, складає для одних і других, які рівні між собою при температурі 22 0С, величину:
[Н+] = [ОН-] = 10-7 мг*іон/см3.
У відповідності із законом діючих мас добуток концентрації іонів водню та
гідроксилу при даній температурі є величиною постійною і визначається константою Кв дисоціації води:
Кв=К [Н2О]= [Н+]∙[ОН-] (9.4)
Кислоти та луги у водних розчинах теж дисоціюють: кислоти на катіони водню та аніони кислотного залишку, а луги – на катіони металу і аніони гідроксилу:
НСl ↔ [Н+] + [Cl-]
NaOH ↔ [Na+] + [OH-]
Якщо розчинити в нейтральному розчині іншу речовину і температуру розчину підтримувати незмінною, то величина 10-14 залишається постійною, але порушується рівновага і в розчині збільшується або кількість дисоційованих катіонів водню [Н+] за рахунок зменшення аніонів гідроксилу [OH-], або навпаки, зростає кількість аніонів гідроксилу за рахунок зменшення катіонів водню. В першому випадку, коли [Н+] > 10-7, розчин набуває кислотні властивості. В іншому випадку, коли [Н+] < 10-7, розчин має лужні властивості.
Для зручнішого визначення концентрації іонів водню датський хімік Зеренсен ввів поняття водневого показника рН (р-Potenz – степінь, Н – хімічний символ водню). У відповідності з визначенням Зеренсена водневий показник рН – це десятковий логарифм концентрації іонів водню, взятий з від’ємним знаком:
рН = -lg [Н+]. (9.5)
Таким чином, концентрацією іонів водню [Н+] можна охарактеризувати будь-який розчин, причому для нейтрального середовища рН дорівнює 7, для лужного – рН>7, а кислого - рН<7.
Дуже кислі розчини можуть мати рН=-1,-2, а концентровані луги рН>14.
Вода є нейтральною тільки при температурі 22 0С. При підвищенні температури до 1000С вода набуває кислі властивості і її рН знижується до 6,12. За нульової температури вода набуває лужні властивості з рН=7,97.
Для водних розчинів діапазон зміни рН складає 0…14.
Потенціометричний метод аналізу складу рідин ґрунтується на вимірюванні потенціалу спеціального електроду, який занурений у контролює мий розчин. Величина потенціалу залежить від природи і концентрації (а вірніше – активності аналізованих іонів в розчині, та властивостей самого розчину) і визначається рівнянням закону Нернста, відкритого для металевих електродів, а пізніше поширеного на електроди інших речовин.
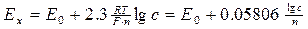 , (9.6)
, (9.6)
де n – валентність іонів металу; E0 – нормальний потенціал електроду із певного метану і не залежить від концентрації іонів, В; R – універсальна газова стала = 8,31 Дж/моль*К; F – число Фарадея (постійна, яка визначає заряд грам-еквівалента-іонів) F=96485; T – абсолютна температура, К та значення потенціалу при температурі розчину 200С.
Виникнення потенціалу пояснюється переходом іонів металу в розчин, а в стані рівноваги – переходом іонів металу в розчин і із розчину в електрод.
Якщо виразити через водневий показник рН, то формула прийме вигляд:
Ex = Е 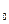 - 0.05806 pH/n. (9.7)
- 0.05806 pH/n. (9.7)
Так як на величину потенціалу вимірювального електроду головним чином впливає концентрація потенціаловизначаючих іонів (катіонів), які обмінюються 3 атомами металу електроду, то велике значення має вибір матеріалу електродів.
В якості вимірювальних електродів найбільш розповсюджені сурм’яні, скляні із нержавіючої сталі, платинові та срібні. Останні два використовуються при потенціометричному титруванні. Перші два використовують при визначенні концентрації водневих катіонів. Найбільше розповсюджені в рН-метрах скляні вимірювальні електроди, потенціалом яких зв’язані з показником рН лінійною залежністю.
Але виміряти різницю потенціалів тільки між одним вимірювальним електродом і розчином не можливо, так як при під єднанні вимірювального приладу до розчину знову ж таки виникає різниця потенціалів між розчином та провідником, який з’єднує розчин з приладом. Відповідно різниця потенціалів, яку повинен виміряти прилад, буде дорівнювати нулю
Тому для утворення електричного ланцюга для вимірювання зрівноваженого поверхневого потенціалу в розчин вводять другий електрод, який називають допоміжним, або електродом порівняння. Потенціал порівняльного електроду в процесі вимірювання повинен бути незмінним, не залежати від концентрації речовин у розчині.
При визначенні концентрації розчинів за активністю іонів водню електричний ланцюг вимірювального перетворювача (вимірювальної комірки) складається із (рис. 9.6) вимірювального електроду 1 з допоміжним внутрішнім електродом 1’ , який необхідний для утворення електричного ланцюга, та допоміжного електроду 2, який також контактує з контролюємим розчином.
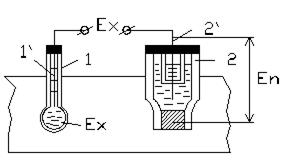
Рис.9.6. Вимірювальна комірка потенціометричного методу
В якості вимірювальних електродів найчастіше використовуються електроди, які виготовлені із скла, або сурми. В якості допоміжних електродів використовуються хлор срібні та каломельні. Разом вони утворюють вимірювальну комірку із каліброваної скляної трубки, до одного кінця якої приварюється мембрана із спеціального електродного скла, в яке додають одновалентні метали К, Na, Li і яке є активною частиною електроду.
Мембрани виготовляються різної форми (в вигляді кульки, списовидна, плоскої – у вигляді голки) в залежності від призначення електроду. В каліброваній частині скляної трубки розміщується 0,1 н. розчину соляної кислоти HCl з невеликої кількості кристалів хлориду срібла. В цей розчин занурюється контактний хлорсрібний електрод 1’ (хлорсрібний), від якого відходить провідник до вимірювального приладу. Електрод герметизують.
Під час занурення вимірювальної комірки у контрольований розчин, на скляному електроді з’являється ЕРС Ex лінійно пов’язана з активністю іонів водню в розчині. Між поверхнею скляної мембрани і розчином відбувається обмін іонами. Домішки одновалентних металів під дією виникаючих електростатичних сил вириваються із вузлів кришталевої силікатної решітки і переходять в розчин, а їх місця займають більш активні катіони водню [Н+], які надходять із розчину.
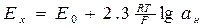 , (9.8)
, (9.8)
де ан - активність іонів водню розчину
Якщо підставити в рівнянні Нернста значення констант при t0= 200С і прийняти Е0=0, то потенціал електроду Ex дорівнює:
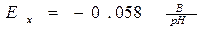 . (9.9)
. (9.9)
І має назву водневої функції і показує, що у разі зміни рН розчину на одиницю, потенціал електроду змінюється на 58 мВ.
Скляні електроди можуть працювати при температурах до 1000С, виготовляються різноманітні скляні електроди для використовування в різних середовищах в занурених і проточних перетворювачах, спеціально для використовування в харчовій промисловості (аналізу молока, кисломолочних продуктів, рослинних олій, тіста). Сурм’яні вимірювальні електроди виготовляються із металевої сурми в вигляді стержня, або платинового проводу, на який наносять шар сурми.
Електродний потенціал виникає на межі металевої сурми і її окису, який утворюється на поверхні металу. Випускаються спеціальні електроди, які самоочищаються і використовуються для контролю кислотності тіста і інших дуже в’язких харчових продуктів.
Як порівняльні електроди використовуються хлор срібні та каломельні. В харчовій промисловості використовування хлорсрібних переважне. Вони являють собою стержень із срібла на поверхню якого наноситься шар малорозчинної солі AgCl. Його розміщують у насиченому калію який через напівпроникну гумову мембрану контактує з вимірювальним розчином і забезпечує замикання електричного ланцюга.
Промисловість випускає датчики зануреного типу ДПг-4м та проточного типу ДМ-5м, перетворювачі П201 і П210; вимірювачі рН-типу рН-201, 205, 261, 265 діапазон вимірювання 1-15 рН клас точності – 1.0;1,5
Для контролю кислотності молока – і молочних продуктів використовуються аналізаторів рН – 222,2. Як вимірювальні використовуються скляні електроди типів ЕСА-45-07 і ЕСА-45-08, які розраховані для вимірювання рН розчинів в діапазоні (3÷8рН) в діапазоні температур від 0 до 400С. Похибка перетворювача ±0,05 рН.
Останнім часом використовуються твердо контактні металізовані скляні електроди, в яких відсутня кислота.
Загальному випадку, якщо розглянути нахил характеристики перетворення електродної системи:
 , (9.10)
, (9.10)
де tр- температура розчину, 0С.
Таким чином зміна температури розчину суттєво впливає на ЕРС електродної системи. Для зменшення впливу зміни температури розчину на результати вимірювань, допоміжні електроди та заповнюючі розчини вибирають таким чином, щоб сумарна зміна ЕРС від температури була мінімальною. Використовуються також введення температурних поправок.
Дата добавления: 2016-01-18; просмотров: 1761;
