Лекция 20. Уровни энергии и спектры атомов щелочных металлов. Спектры атомов второй группы
Спектры атомов второй группы
Группа атомов щелочных металлов – литий, натрий, калий, рубидий, цезий – непосредственно следует за благородными газами. Эти газы имеют завершенную структуру электронных оболочек, что объясняет их слабую химическую активность и высокие ионизационные потенциалы. Химические и оптические свойства атомов щелочных металлов определяются именно этим одним валентным электроном. Валентные электроны атомов щелочных металлов находятся в s–состояниях, которые характеризуются разными значениями главного квантового числа: Li – 2s, Na – 3s, K – 4s, Rb – 5s, Cs – 6s.
В атоме щелочного металла валентный Z-й электрон находится в электрическом поле, образованном зарядом ядра Ze и остальными Z-1 электронами атома. Это электронный остов. В этом случае электрическое поле не является кулоновским, так как электронный заряд распределяется по всему объему атомаЭнергию взаимодействия валентного электрона с остовом можно представить в виде:
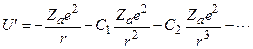 (3.41)
(3.41)
Первый член описывает энергию взаимодействия валентного электрона с положительным зарядом, сосредоточенным в центре атома, второй член – энергию взаимодействия с электрическим диполем и т.д
Уровни энергии атомов щелочных металлов определяются формулой:
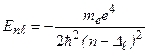 , (3.44)
, (3.44)
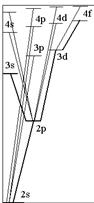 где
где 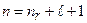 – главное квантовое число. Величина
– главное квантовое число. Величина 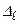 - квантовый дефект. В отличие от водородоподобного атома уровни энергии атомов щелочных металлов зависят не только от главного квантового числа, но и от орбитального квантового числа. В этом случае говорят, что происходит устранение вырожденияпо орбитальному квантовому числу. С возрастанием орбитального квантового числа роль поправки
- квантовый дефект. В отличие от водородоподобного атома уровни энергии атомов щелочных металлов зависят не только от главного квантового числа, но и от орбитального квантового числа. В этом случае говорят, что происходит устранение вырожденияпо орбитальному квантовому числу. С возрастанием орбитального квантового числа роль поправки 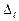 ослабевает.
ослабевает.
Основное состояние атома лития – 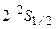 .Первый возбужденный уровень –
.Первый возбужденный уровень – 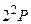 . В соответствии с правилами отбора возможны переходы в основное состояние со всех возбужденных р–уровней. Эти переходы вызывают
. В соответствии с правилами отбора возможны переходы в основное состояние со всех возбужденных р–уровней. Эти переходы вызывают
излучение, спектральные линии которого относятся к главной серии:
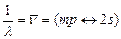 , (m = 2, 3, … ).
, (m = 2, 3, … ).
Эта серия легко наблюдается как в испускании, так и в поглощении. Другие спектральные серии связаны с разрешенными переходами между возбужденными уровнями энергии:
первая побочная,или диффузная серия: 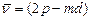 ,
,
вторая побочная,или резкая серия: 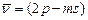 ,
,
серия Бергмана, или фундаментальная серия: 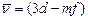 .
.
Атом гелия содержит два электрона. Их моменты складываются по правилу нормальной связи. В случае синглетов число S = 0, квантовое число J принимает значения:
J = L. (3.46)
У атома гелия и ему подобных атомов синглетные состояния:
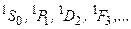 (3.46a)
(3.46a)
В случае триплетов S = 1:
J = L+1, L, L – 1. (3.46б)
Соответствующие триплетные состояния:
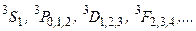 (3.46в)
(3.46в)
Решение уравнения Шредингера 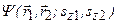 , зависящее от координат электронов и спиновых переменных, ищется в виде произведения двух функций:
, зависящее от координат электронов и спиновых переменных, ищется в виде произведения двух функций: 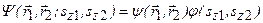 . По принципу Паули волновая функция
. По принципу Паули волновая функция 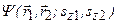 должна быть антисимметричной по всем своим переменным.
должна быть антисимметричной по всем своим переменным.
Синглетные состояния атома гелия - парасостояния,триплетные – ортосостояния.Из(3.47а): основное состояние атома гелия не может быть триплетным, так как 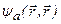 = 0. Отсюда же вытекает, что в ортосостояниях оба электрона не могут иметь одинаковые квантовые числа.
= 0. Отсюда же вытекает, что в ортосостояниях оба электрона не могут иметь одинаковые квантовые числа.
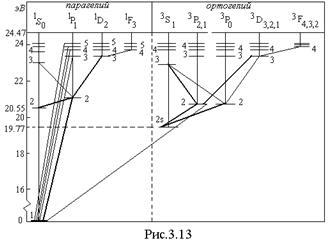 Для атома гелия существуют те же спектральные серии, что и для атомов щелочных металлов, но только в двух экземплярах, соответствующих синглетам и триплетам: две главные серии, две первых побочных, две вторых побочных серий и т.д. (рис.3.13). Характерная желтая линия
Для атома гелия существуют те же спектральные серии, что и для атомов щелочных металлов, но только в двух экземплярах, соответствующих синглетам и триплетам: две главные серии, две первых побочных, две вторых побочных серий и т.д. (рис.3.13). Характерная желтая линия 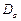 , по которой был открыт гелий (Жансен, Локьер, 1868) в спектре солнечных протуберанцев, является триплетом с длинами волн 5875,963; 5875,643 и 5875,601
, по которой был открыт гелий (Жансен, Локьер, 1868) в спектре солнечных протуберанцев, является триплетом с длинами волн 5875,963; 5875,643 и 5875,601 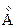 и отношением интенсивностей 1: 3: 5. Она представляет собой головной триплет первой побочной серии. Из-за очень малого различия двух последних длин волн эту линию долго считали дублетом. Главная серия триплетов находится в инфракрасной части спектра, а синглетов – в ультрафиолетовой части.
и отношением интенсивностей 1: 3: 5. Она представляет собой головной триплет первой побочной серии. Из-за очень малого различия двух последних длин волн эту линию долго считали дублетом. Главная серия триплетов находится в инфракрасной части спектра, а синглетов – в ультрафиолетовой части.
Два электрона атома гелия заполняют К–слой (электронная конфигурация – 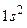 ). Основное состояние –
). Основное состояние – 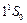 . Все остальные состояния как в синглетах, так и в триплетах являются возбужденными. Замкнутая оболочка гелия очень прочна. Поэтому его основной терм расположен намного ниже, чем у атома водорода. Потенциал ионизации гелия имеет наибольшее значение среди всех других элементов:
. Все остальные состояния как в синглетах, так и в триплетах являются возбужденными. Замкнутая оболочка гелия очень прочна. Поэтому его основной терм расположен намного ниже, чем у атома водорода. Потенциал ионизации гелия имеет наибольшее значение среди всех других элементов: 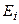 = 24,5 эВ. Состояние
= 24,5 эВ. Состояние 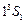 отсутствует: четверка квантовых чисел для обоих электронов совпадает:
отсутствует: четверка квантовых чисел для обоих электронов совпадает: 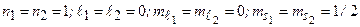 . Отсутствие терма
. Отсутствие терма 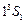 прямое следствие принципа Паули. Первое возбужденное состояние атома гелия
прямое следствие принципа Паули. Первое возбужденное состояние атома гелия 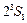 с энергией возбуждения 19,82 эВ относится к триплетам. Это состояние является метастабильным со временем жизни 7900 с. Синглетное состояние
с энергией возбуждения 19,82 эВ относится к триплетам. Это состояние является метастабильным со временем жизни 7900 с. Синглетное состояние 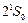 также является метастабильным. Его энергия возбуждения 20,62 эВ и время жизни 0,02 с. Нижний резонансно возбужденный уровень
также является метастабильным. Его энергия возбуждения 20,62 эВ и время жизни 0,02 с. Нижний резонансно возбужденный уровень 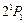 имеет энергию возбуждения 21,22 эВ и время жизни 0,56
имеет энергию возбуждения 21,22 эВ и время жизни 0,56 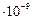 с.
с.
Атомы второй группы щелочно–земельные
металлы: Be, Mg, Ca, Sr, Ba, Ra. В эту группу входят также: Zn, Cd, Hg. Эти элементы, как и атом гелия, имеют заполненную внешнюю s–оболочку. Их основным состоянием является 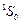 , и спектры аналогичны спектру атома гелия.
, и спектры аналогичны спектру атома гелия.
Особенности системы термов и спектра атома ртути (рис. 3.14). Основное состояние 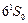 с электронной конфигурацией
с электронной конфигурацией 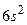 . Триплетные P–уровни с конфигурацией
. Триплетные P–уровни с конфигурацией 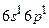 имеют энергию возбуждения 4,67 эВ, 4,89 эВ и 5,46 эВ. Согласно правилам отбора переходы с этих уровней в основное состояние невозможны. Поэтому состояния
имеют энергию возбуждения 4,67 эВ, 4,89 эВ и 5,46 эВ. Согласно правилам отбора переходы с этих уровней в основное состояние невозможны. Поэтому состояния 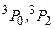 метастабильные. Вместе с тем, наблюдается достаточно интенсивная «запрещенная» линия с длиной волны
метастабильные. Вместе с тем, наблюдается достаточно интенсивная «запрещенная» линия с длиной волны 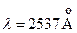 . Она возникает при интеркомбинационном переходе
. Она возникает при интеркомбинационном переходе 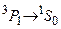 . Нижние P–уровни в триплетах имеют более низкую энергию, чем низший синглетный уровень
. Нижние P–уровни в триплетах имеют более низкую энергию, чем низший синглетный уровень 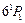 c энергией 6,78 эВ. Линия
c энергией 6,78 эВ. Линия 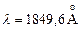 , соответствующая переходу
, соответствующая переходу 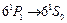 , в 30 раз интенсивнее интеркомбинационной линии. Вспомним опыты Франка и Герца. Открытый ими дискретный уровень атома ртути с энергией около 4,9 эВ соответствует возбужденному состоянию
, в 30 раз интенсивнее интеркомбинационной линии. Вспомним опыты Франка и Герца. Открытый ими дискретный уровень атома ртути с энергией около 4,9 эВ соответствует возбужденному состоянию 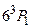 . Переход атома ртути из основного, синглетного состояния в возбужденное триплетное состояние при неупругих соударениях с электроном обусловлен изменением направления спина рассеянного электрона:
. Переход атома ртути из основного, синглетного состояния в возбужденное триплетное состояние при неупругих соударениях с электроном обусловлен изменением направления спина рассеянного электрона: 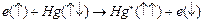 . Стрелками обозначены направления спина сталкивающегося электрона и электронов атома ртути. Звездочка означает возбужденный атом. Указанная схема отвечает сохранению полного спина системы «электрон + атом».
. Стрелками обозначены направления спина сталкивающегося электрона и электронов атома ртути. Звездочка означает возбужденный атом. Указанная схема отвечает сохранению полного спина системы «электрон + атом».
Дата добавления: 2016-01-16; просмотров: 1796;
