Классификация электродов
Электроды классифицируют по химической природе веществ, участвующих в электродном процессе.
В электродах первого рода восстановленной формой является металл электрода, а окисленной формой – ионы этого металла. Как правило, электроды первого рода обратимы по катиону (т.е. их потенциал является функцией активности катиона). Примерами электрода первого рода являются электроды элемента Даниэля-Якоби:
 ,
,
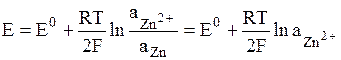 .
.
Если в электродных процессах участвуют чистые твердые или жидкие вещества, то их активности равны единице.
Общее уравнение для электродов I рода имеет вид:
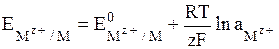 . (7)
. (7)
К электродам первого рода относятся амальгамные электроды, в которых восстановленной формой является – сплав металла с ртутью (элемент Вестона) Cd2+ + 2e = Cd(Hg):
 .
.
Электроды второго рода состоят из металла, покрытого слоем его труднорастворимой соли, погруженного в раствор, содержащий анионы этой соли. Окисленной формой является труднорастворимая соль, а восстановленной – металл и анион соли. Электроды второго рода обратимы по аниону (т.е. их потенциал является функцией активности аниона). Примерами электродов второго рода являются следующие широко распространенные электроды сравнения:
- хлоридсеребряный электрод (обозначается Ag│AgCl│Cl-);
электродная реакция AgCl + e = Ag + Cl-,
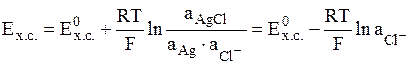 .
.
- каломельный электрод (обозначается Hg│Hg2Cl2│Cl-);
электродная реакция Hg2Cl2 + 2e = 2Hg + 2Cl-,
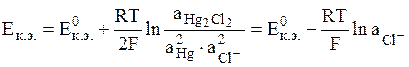
Общий вид уравнения Нернста для электродов II рода:
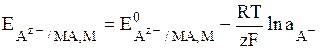 (8)
(8)
Окислительно-восстановительные, или редокс-электроды состоят из инертного металла, который не участвует в реакции, а является переносчиком электронов между окисленной и восстановленной формами вещества.
Одним из лучших материалов для реализации окислительно-восстановительного равновесия является платина, в качестве же реагента можно взять, например, хингидрон. Это эквимолярная смесь хинона С6Н402 и гидрохинона С6Н4(ОН)2, между которыми в водном растворе в присутствии платины устанавливается электрохимическое равновесие:
С6Н4О2 +2 Н30+ + 2е = С6Н4(ОН)2 + 2 Н2О.
Потенциал, устанавливающийся на Pt-электроде при рН < 8.5, определяется лишь активностью ионов гидроксония:
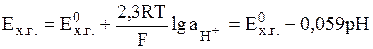 (9)
(9)
поскольку активности хинона и гидрохинона примерно равны, а активность воды близка к единице. Стандартный потенциал хингидронного электрода Е0хг при 298 К составляет 0,699 В.
К окислительно-восстановительным электродам относятся газовые электроды. Газовый электрод состоит из инертного металла, к которому попадает газ, участвующий в электродном процессе. Восстановленной формой является газ, а окисленной – ионы в растворе. Наиболее известным примером газового электрода является водородный электрод. Его записывают в виде: Pt│H2│H+; электродная реакция: 2Н+ + 2е = Н2; уравнение для определения потенциала:
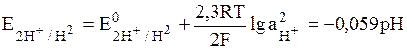 (10)
(10)
Если два раствора разделены физической границей конечной толщины, обладающей избирательной пропускной способностью по отношению к частицам различного сорта, то такая граница является мембраной. На основе полупроницаемых мембран, обладающих повышенной избирательностью к определенным ионам, созданы ионселективные электроды. С определенным допущением к ионселективным электродам с твердой мембраной относят стеклянный электрод, селективный по отношению к ионам Н3О+. Как показывает теоретический анализ, если рН < 12, то потенциал стеклянного электрода описывается формулой:
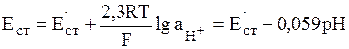 (11)
(11)
В этом выражении Е'ст является константой для данного электрода, т.к. зависит от сорта стекла, типа электрода сравнения и ряда иных факторов.
Хингидронный, водородный и стеклянный электроды часто применяют для определения рН растворов.
Дата добавления: 2016-01-09; просмотров: 5340;
