Химические свойства аминов
Основные свойства аминов
Амины являются основаниями, так как атом азота может предоставлять электронную пару для образования связи с электроннедоетаточными частицами по донорно-акцепторному механизму (соответствие определению основности по Льюису). Поэтому амины, так же как и аммиак, способны взаимодействовать с кислотами и водой, присоединяя протон с образованием соответствующих аммониевых солей.
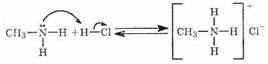
Аммониевые соли хорошо растворимы в воде, но плохо растворяются в органических растворителях. Водные растворы аминов обладают щелочной реакцией:
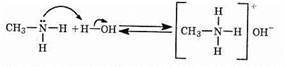
Основные свойства аминов зависят от природы заместителей. В частности, ароматические амины — более слабые основания, чем алифатические, т.к. свободная электронная пара азота вступает в сопряжение с p-системой ароматического ядра, что уменьшает электронную плотность на атоме азота (-М-эффект). Напротив, алкильная группа является хорошим донором электронной плотности (+I-эффект).

Окисление аминов
Горение аминов сопровождается образованием углекислого газа, азота и воды:
4CH3NH2+9О2=4СO2+2N2+10Н2О
Ароматические амины самопроизвольно окисляются на воздухе. Так, анилин быстро буреет на воздухе вследствие окисления.
Присоединение алкилгалогенидов Амины присоединяют галогеналканы с образованием соли:
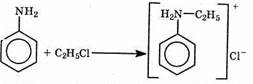
Обрабатывая получившуюся соль щелочью, можно получить свободный амин:
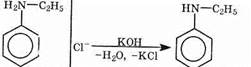
Взаимодействие аминов с азотистой кислотой Огромное значение имеет реакция диазотирования первичных ароматических аминов под действием азотистой кислоты, получаемой in situ по реакции нитрита натрия с соляной кислотой:
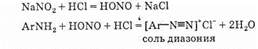
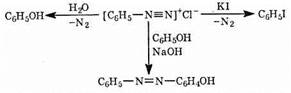
Первичные алифатические амины при реакции с азотистой кислотой образуют спирты, а вторичные алифатические и ароматические амины дают N-нитрозопроизводные:
R-NH2 + NaNO2+НСl=R-OH+N2+NaCl+H2O
R2NH+NaNO2+HCl=R2N-N=O+NaCl+H2O
Ароматическое электрофильное замещение в ароматических
аминах
В ароматических аминах аминогруппа облегчает замещение в орто- и пара-положениях бензольного кольца. Поэтому галогенирование анилина происходит быстро и в отсутствие катализаторов, причем замещаются сразу три атома водорода бензольного кольца, и выпадает белый осадок 2,4,6-триброманилина:
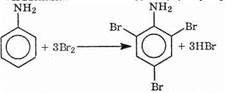
Эта реакция бромной водой используется как качественная реакция на анилин.
Применение
Амины применяются в фармацевтической промышленности и органическом синтезе (CH3NH2, (CH3)2NH, (C2H5)2NH и др.); при производстве найлона (NH2-(CH2)6-NH2 — гексаметилендиамин); в качестве сырья для производства красителей и пластмасс (анилин).
Дата добавления: 2016-01-03; просмотров: 2408;
