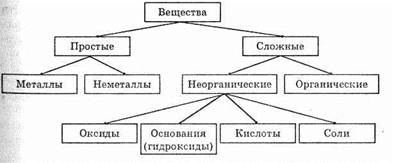
Простые и сложные вещества
Для систематизации информации об известных науке веществах их объединяют в группы по сходности состава, строения и химических свойств. Все вещества можно разделить на две обширные группы — простых и сложных веществ.
Простые вещества — это вещества, образованные из атомов одного элемента.______________________________________
Например, простое вещество уголь образовано атомами элемента углерода, простое вещество железо — атомами элемента железа, простое вещество азот — атомами элемента азота.

Так, оксид меди (II) образован атомами элементов меди и кислорода, вода — атомами элементов водорода и кислорода.
Понятие «простое вещество» нельзя отождествлять с понятием «химический элемент». Простое вещество характеризуется определенной плотностью, растворимостью, температурой кипения и плавления и т.п. Эти свойства относятся к совокупности атомов, и для разных простых веществ они различны. Химический элемент характеризуется определенным положительным зарядом ядра атома (порядковым номером), степенью окисления, изотопным составом и т.д. Свойства элементов относятся к его отдельным атомам. Сложные вещества состоят не из простых веществ, а из элементов. Например, вода состоит не из простых веществ кислорода и водорода, а из элементов кислорода и водорода. Названия элементов обычно совпадают с названиями соответствующих им простых веществ (исключения: углерод и одно из простых веществ кислорода — озон).
Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией, а образующиеся вещества — аллотропными видоизменениями или модификациями. Так, элемент кислород образует две аллотропные модификации — кислород и озон; элемент углерод — три: алмаз, графит и карбин; несколько модификаций образует элемент фосфор.
Явление аллотропии вызывается двумя причинами:
1) различным числом атомов в молекуле (например, кислород O2 и озон О3) или
2) образованием различных кристаллических форм (например, алмаз, графит и карбин, см. §7.2).
Простые вещества делят на металлы и неметаллы. Неметаллов известно всего 22. Это водород, гелий, бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат, радон.
Сложные вещества можно разделить на две большие категории: неорганические и органические. К органическим веществам относятся практически все соединения углерода, за исключением его оксидов, солей угольной кислоты, карбидов и некоторых других. Органические вещества будут рассмотрены несколько позже.
Сложные неорганические вещества принято подразделять на четыре класса: оксиды, основания (гидроксиды), кислоты, соли. Кроме того, выделяют также класс комплексных соединений. Данная классификация является традиционной, но не отражает всего многообразия известных сложных неорганических веществ. Так, например, аммиак (NH3), пентакарбонил железа (Fe(CO)5), гидрид лития (LiH), амид натрия (NaNH2) не учитываются в этой схеме.
Рассмотрим поподробнее основные классы.

По химическим свойствам оксиды разделяются на солеобразующие и несолеобразующие.
Солеобразующие оксиды образуют три подкласса: кислотные, амфотерные и основные. Отнесение оксида к той или иной группе происходит на основе теории электролитической диссоциации.
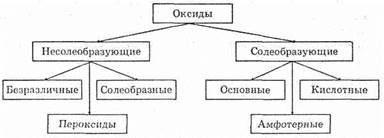

Кислотные оксиды — это оксиды неметаллов (SO2, SO3, CO2, Р2О5, и др.) и некоторых металлов в высоких степенях окисления (CrО3, Mn2О7 и др.).

Основные оксиды образуют металлы (Na2O, SrO, CuO)

Как видно из этого определения, амфотерные оксиды проявляют свойства, характерные Как для кислотных, так и для основных оксидов. Амфотерные свойства Проявляют оксиды металлов, с неярко выраженными металлическими свойствами. Например, Аl2О3, ZnO. Переходные металлы, для которых возможны несколько степеней окисления, также образуют амфотерные оксиды. Например, Fe2O3, Cr2О3.
Необходимо отметить, что реакции оксидов с щелочами и кислотами, упоминающиеся в данных определениях и служащие для отнесения оксидов к той или иной группе, обязательно должны проходить без изменения степени окисления.
К несолеобразующим оксидам относятся оксид углерода (II) СО, оксид азота (II) NO, оксид азота (I) N2O и некоторые другие.
Номенклатура оксидов
По принятым в настоящий момент правилам названия оксидов состоят из слова «оксид», после которого ставится название элемента и в скобках римскими цифрами — степень окисления элемента в данном оксиде, если для этого элемента возможны несколько оксидов.
Например: FeO — оксид железа (II), Fe2O3 — оксид железа (III);
Cu2О — оксид меди (I), CuO — оксид меди (II); ]
N2O — оксид азота (I), NO — оксид азота (II), N2O3 — оксид азота (III), NO2 — оксид азота (IV), N2O5 — оксид азота (V)
Получение оксидов
Многие оксиды можно получить при окислении кислородом соответствующих простых веществ:
S+O2=SO2
4Р+5О2=2Р2О5
2Н2+О2=2Н2О
2Са+O2=2СаО
2Cu+02=2CuO
2Zn+O2=2ZnO
N2+O2=2NO (электр. разряд)
Оксиды щелочных металлов (Na2O, K2O и др.) таким способом получить нельзя, так как, будучи чрезвычайно активными, они образуют перекиси (Na2O2, K2O2).
Оксиды элементов в невысоких степенях окисления могут окисляться далее кислородом в соответствующих условиях:
2S+4O2+О2=k2S+6O3
4Fe+2O+О2=2Fe+32O3
2С+2О + O2 = 2С+4O2
Гидроксиды многих металлов (но не щелочных) при нагревании разлагаются на оксид металла и воду (оксид водорода):
Cu(OH)2=CuO+H2O
Нагревание некоторых кислот приводит к их разложению на кислотный оксид и воду:
Некоторые соли кислородсодержащих кислот при нагревании могут разлагаться на оксиды:
СаСO3=tСаО+СО2
4Fe(NO3)2=t2Fe2O3+8NO2+O2
Окисление сульфидов тяжелых металлов кислородом (обжиг) приводит к образованию оксида металла и оксида серы (IV): 4FeS2+11O2=2Fe2O3+8SO2 2CuS+3O2=2CuO+2SO2
Свойства оксидов
Основные оксиды
Основные оксиды взаимодействуют с растворами кислот с образованием соли (средней, кислой или основной) и воды. Это признак основных оксидов. В данном случае имеется в виду реакция без изменения степеней окисления.
СаО+H2SO4=CaSO4+Н2O
CuO+НСl=CuCl2+H2O
MgO+HCl=(MgOH)Cl
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием гидроксидов: Li2O+Н2O=2LiОН К2О+Н2O=2КОН
ВаО+Н2О=Ва(ОН)2
Основные оксиды могут при нагревании взаимодействовать с кислотными и амфотерными оксидами с образованием солей. СаО + SiO2=CaSiO3 Na2O+Аl2O3=2NaAlO2
Многие оксиды металлов способны восстанавливаться до простых веществ:
CuO+Н2=Cu+Н2O
Кислотные оксиды
Любому кислотному оксиду соответствует кислородсодержащая кислота, в которой неметалл проявляет ту же степень окисления, что и в оксиде.
Кислотные оксиды реагируют с растворами щелочей с образованием соли и воды. Так же, как и в случае основных оксидов, имеется в виду реакция без изменения степеней окисления. (Возможно также образование кислой или основной соли):
SO2+2NaOH=Na2SO3+Н2О
SO3+NaOH=NaHSO4
CO2+2Mg(OH)2=(MgOH)2CO3+H2O SiO2+2NaOH=Na2SiO3+H2O
Кислотные оксиды, как правило, реагируют с водой. При этом образуется соответствующая кислота, если она растворима в воде.
SO2+Н2O = H2SO3
SO3+Н2O=H2SO4 Сl2O7+Н2О=2НClO4
Кислотные оксиды называют ангидридами соответствующих кислот. Например, сернистый ангидрид (SO2),.серный ангидрид (SO3), ангидрид хлорной кислоты (Сl2О7), фосфорный ангидрид
(Р2O5).
Кислотные оксиды могут при нагревании взаимодействовать с основными и амфотерными оксидами с образованием солей. SiO2+BaO=BaSiO3; Р2O5+3Na2O=2Na3PO4; 3SO3+Al2O3=Al2(SO4)3
Кислотные оксиды могут выступать в окислительно-восстановительных реакциях в качестве как восстановителя, так и окислителя.
Р2O5+5С=5СО+2Р;
SO2+О2=SO3.
Амфотерные оксиды
Взаимодействие с растворами (и расплавами) щелочей с образованием соли и воды и с растворами кислот с образованием соли и воды (без изменения степеней окисления).
Al2O3+2NaOH+7H2O=2Na[Al(OH)4•2Н2O] (раствор)
тетрагидроксиалюминат натрия
Al2O3+2NaOH=2NaAlO2+H2O (расплав) Аl2О3+6НСl=2АlСl3+3Н2О
Амфотерные оксиды при нагревании взаимодействуют с кислотными и основными оксидами с образованием солей. (Возможны также реакции между двумя амфотерными оксидами, в которых один выступает как основной, а другой как кислотный).
Fe2O3+CaO=CaFeO2
Fe2O3+FeO=Fe[FeO2]2
Fe2O3+SO3=Fe2(SO4)3
Амфотерные оксиды также, как и оксиды других типов, могут восстанавливаться до металла.
Кислоты
Согласно теории электролитической диссоциации

Примеры кислот: H2SO4 — серная кислота, H2SO3 — сернистая кислота, H2S — сероводородная кислота, НС1 — соляная (хлороводородная) кислота, HBr — бромоводородная кислота, HNO3 — азотная кислота.
Наряду с протоном, при растворении кислоты в воде в растворе появляются отрицательно заряженные ионы кислотного остатка. Если кислотный остаток состоит из нескольких атомов и содержит атомы кислорода, например, NO-3, SO2-4, то такие кислоты называются кислородсодержащими. Если атомов кислорода в кислотном остатке нет, например, Сl-, Br-, S2-, то кислота бескислородная.
Число атомов водорода, способных отщепиться при растворении или заместиться на ионы металлов, определяет основность кислоты. Например, одноосновные кислоты НСl, HBr, HNO3, двухосновные кислоты H2SO4, H2SiO3, трехосновная кислота Н3РO4,
Номенклатура кислот
Названия кислот строятся от названия элементов, их образующих. Например, H2SiO3 — кремниевая кислота, Н3ВО3 — борная кислота. Элемент может образовывать несколько кислот. Их названия определяются степенью окисления. Если кислота образована элементом в высшей степени окисления (обычно равной номеру группы), то ее название строится при помощи прибавления
к названию элемента буквосочетаний -ная (H2S+6O4 — серная кислота), или -овая (H2Se+6O4 — селеновая кислота). Понижение степени окисления отражается изменением окончания на -оватая, -истая, -оватистая в порядке понижения степени окисления. Правила номенклатуры кислот хорошо прослеживаются на названиях кислот хлора.
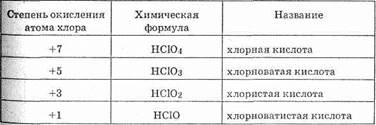
Другие примеры: HN+ 5 O3 — азотная кислота, HN+3O2 —азотистая кислота, H2S+6O4 — серная кислота, H2S+4O3 — сернистая кислота.
Названия бескислородных кислот строятся прибавлением к корню элемента -оводородная кислота. Например, HBr — бромоводородная кислота, H2S — сероводородная кислота. Для хлороводородной кислоты НС1 чаще применяется тривиальное название — соляная кислота.
Получение кислот
Кислородсодержащие кислоты могут быть получены при взаимодействии их ангидридов (соответствующих кислотных оксидов) с водой:
SO2+Н2О=H2SO3
SO3+Н2О=H2SO4
Кислоты, состоящие из атомов двух элементов, можно получать при реакции соответствующих простых веществ:
S+Н2=H2S
Br2+Н2 = 2HBr
Летучие кислоты можно вытеснить из их солей нелетучими кислотами:
NaCl+Н2SO4(конц)= HCl +NaHSO4
Свойства кислот
Наличие протона, способного при растворении отщепляться от молекулы кислоты, определяет схожесть некоторых свойств всех кислот.
Реакция нейтрализации. При взаимодействии кислоты с основанием образуется соль (средняя, кислая или основная) и вода:
НСl+NaOH=NaCl+Н2О
H2SO4+NaOH=NaHSO4+H2O
H2SO4+2NaOH=Na2SO4+2H2O
H2SiO3+2NaOH=Na2SiO3+2H2O
H2SO4+Cu(OH)2=CuSO4+2H2O
Кислоты реагируют с основными и амфотерными оксидами. При этом амфотерные оксиды проявляют свойства основных.
2НСl+FeO=FeCl2+Н2О
6НСl+Fe2O3=2FeCl3+3Н2O
2Н3РO4 +3СаО=Са3(РO4)2+3Н2О
Растворы кислот окисляют металлы, находящиеся в ряду напряжений левее водорода. В результате образуется соль и газообразный водород. Степень окисления элемента, образующего кислоту, не изменяется. Общая схема реакции:
M+2nН+=Mn+ + nH2
Например,
Zn+2HCl=ZnCl2+H2 Fe+H2SO4=FeSO4+H2
Взаимодействие растворов кислот с металлами, стоящими в ряду напряжения после водорода, не происходит.
Взаимодействие кислот, являющихся сильными окислителями, таких, как азотная кислота и концентрированная серная кислота, с металлами не приводит к выделению водорода.
Окислительные свойства кислот. Кислоты, образованные элементами с высокой электроотрицательностью в высоких степенях окисления, обладают сильными окислительными свойствами, особенно концентрированные растворы. Например, серная (степень окисления серы +6), азотная (степень окисления азота +5) окисляют многие металлы, стоящие в ряду напряжений после водорода, неметаллы и некоторые сложные вещества.
2Н2SО4(конц)+Cu=CuSO4+SO2+2Н2О 5HNO3+3Р+2Н2О=3Н3РО4+5NO
Восстановительные свойства проявляются у кислот, образованных элементами в отрицательных и невысоких положительных степенях окисления.
4НСl+MnO2+MnСl2+CI2+2Н2О
H2S+Cl2=Si
При нагревании некоторые кислоты разлагаются:
H2SiO3=Н2O+SiO2
Нелетучие кислоты вытесняют более летучие из их солей.
Н2SO4(конц)+NaCl(n)=NaHSO4+HCl
Более сильные кислоты вытесняют менее сильные кислоты из растворов их солей:
2НСl+Na2CO3=2NaCl+CO2+Н2O
H2SO4+Na2SO3=2Na2SO4+SO2+H2O
Основания
С точки зрения теории электролитической диссоциации

К основаниям относятся гидроксиды металлов, например КОН, Са(ОН)2,Fе(ОН)3 и др.
Число гидроксильных групп называется кислотностью основания. Основания могут содержать одну или несколько гидроксо-групп: однокислотные (NaOH, КОН), двухкислотные (Са(ОН)2, Cu(ОН)2), трехкислотные (Аl(ОН)3) и т.д.
Основания бывают растворимые и нерастворимые. Растворимые в воде основания представляют собой гидроксиды щелочных и щелочноземельных металлов (NaOH, КОН, Са(ОН)2, Ва(ОН)2 и т.д.). Их называют щелочами. Остальные металлы образуют практически нерастворимые гидроксиды. К ним относятся, например, Cr(OH)2, Cr(OH)3, Cu(OH)2.
Гидроксиды металлов можно разделить на основные и амфотерные. Основные гидроксиды взаимодействуют с кислотами и кислотными оксидами с образованием соли и воды. Амфотерные гидроксиды могут реагировать как с кислотами и кислотными оксидами, такие щелочами при нагревании или сплавлении. При взаимодействии с кислотами амфотерные гидроксиды проявляют свойства оснований, а при взаимодействии со щелочами они проявляют свойства кислот.
К основным относятся гидроксиды, которые соответствуют основным оксидам, например, LiOH (Li2O), NaOH (Na2O), КОН (K2O), Ca(OH)2 (CaO), Ba(OH)2 (BaO), Cu(OH)2 (CuO), Fe(OH)2 (FeO), а к амфотерным — те, которым соответствуют амфотерные оксиды, например, Аl(ОН)3 (Аl2О3), Fe(OH)3 (Fe2O3), Cr(OH)3 (Cr2O3).
Номенклатура оснований
Названия оснований образуются так же, как и названия оксидов, только вместо слова «оксид» ставят «гидроксид». Например: LiOH— гидроксид лития, Sr(OH)2 — гидроксид стронция, Аl(ОН)3 — гидроксид алюминия, Fe(OH)2 — гидроксид железа (II), Fe(OH)3 — гидроксид железа (III)
Получение оснований
Растворимые основания образуются при реакции с водой щелочных и щелочноземельных металлов или их оксидов:
2K+2H2O=2KOH+H2 Li2О+Н2O =2LiOH Ва+2Н2О=Ва(ОН)2+H2 СаО+Н2О=Са(ОН)2
Основания можно также получать путем обменных реакций. Таким образом получают нерастворимые гидроксиды:
Fe2(SO4)3+NaOH=Fe(OH)3¯+Na2SO4 CuCl2+2KOH=Cu(OH)2¯+2KCl
Свойства оснований
Все основания взаимодействуют с кислотами с образованием соли и воды (реакция нейтрализации): Cu(ОН)2+HNO3=Cu(NO3)2+Н2О LiOH+HCl=LiCl + H2O
Основания реагируют с кислотными оксидами: 2КОН + S02 = K2SO3 + Н2О
2Fe(OH)3+3SO3=Fe2(SO4)3+3H2O
Щёлочи взаимодействуют также и с амфотерными оксидами при нагревании или сплавлении. При этом амфотерные Оксиды проявляют свойства кислотных:
2NaOH+ZnO+H2O=Na2[Zn(OH)] (реакция в растворе) КОН+Cr2О3=KCrО2+Н2О (реакция при сплавлении)
Нерастворимые амфотерные гидроксиды растворяются в концентрированных растворах щелочей при нагревании (проявление кислотных свойств амфотерных гидроксидов):
Cr(ОН)3+3KOH=K3[Cr(ОН)6]
Аl(ОН)3+NaOH+2Н2O=Na[Al(OH)4•2Н2O]
Возможны также реакции при сплавлении амфотерного гидроксида с щелочью (проявление кислотных свойств амфотерных гидроксидов):
А1(ОН)3+NaOH=NaAlO2+2Н2O
При нагревании все плохо растворимые основания разлагаются на соответствующий оксид и воду:


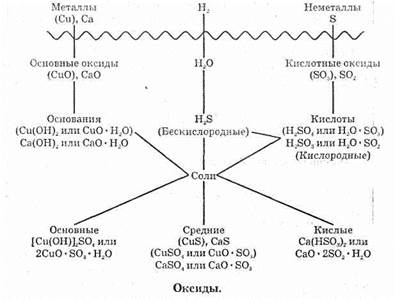
Примеры средних солей: CuSO4, KNO3, FeCl3, Ca3(PO4)2.
Примеры кислых солей: Ca(HSO4)2, NaHCO3.
Примеры основных солей: [Cu(OH)]2CO3, (MgOH)Cl.
Известны также соли, которые содержат в своем составе два различных катиона, например, KCr(SO4)2, CaCO3•MgCO3. Такие соли называются двойными. Существуют и соли, в которых содержится два различных аниона, — смешанные соли, например Са(ОСl)Сl.
Номенклатура солей
Названия солей состоят из двух слов, первое из которых представляет собой название кислотного остатка, а второе — название катиона. Если металл имеет переменную валентность, то в скобках указывают его валентность в данной соли.
Названия кислых солей отличаются от названий средних приставкой гидро- или дигидро-, если соль содержит два незамещенных атома водорода. Названия основных солей начинаются с приставки гидрокси-.
Название кислотного остатка строится от названия элемента, образующего кислоту. Если кислота бескислородная, то к названию неметалла прибавляется суффикс -ид, например MgCl2 — хлорид магния (магниевая соль хлороводородной кислоты), NH4Br — бромид аммония (аммониевая соль бромоводородной кислоты, Na2S — сульфид натрия (натриевая соль сероводородной кислоты).
Названия кислотных остатков кислородсодержащих кислот образуются прибавлением суффикса -ат к корню латинского названия элемента, образующего кислоту, если элемент имеет высшую степень окисления. Например, кислотный остаток серной кислоты — сульфат (SO2-4), азотной — нитрат (NO-3), угольной — карбонат (СО2-3). Кислотные остатки кислот, образованных элементами VII группы в высшей степени окисления, имеют в дополнение к этому суффиксу приставку пер-, а в степени окисления, следующей после высшей, такая приставка отсутствует. Например, перхлорат (СlO-4), пербромат (BrO-4), перманганат (MnO-4)
хлорат (СlO3), бромат (BrO-3), манганат (MnО2-4). Низкие степени окисления элементов, образующих кислоты, отражаются в названиях кислотных остатков с помощью суффикса -ит, и последующим прибавлением приставки гипо- по мере понижения степени окисления. Например, сульфит (SO2-3), нитрит (NO-2), хлорит (ClO-2), гипохлорит (СlO-).
Получение солей
Соли являются продуктами реакций между кислотами и основаниями, кислотами и основными и амфотерными оксидами и гидроксидами, а также в других взаимодействиях, описанных в разделах, посвященных свойствам оксидов, кислот и оснований.
Соли также можно получить в реакциях ионного обмена между солями. Такие реакции проходят до конца в тех случаях, когда происходит образование недиссоциирующих продуктов, т. е. выпадение осадка, выделение газа. Частным случаем реакции ионного обмена является реакция нейтрализации между кислотой и основанием, при которой образуется малодиссоциирующее соединение — вода (см. выше).
CuСl2+Na2S=CuS¯+2NaCl
BaNO3+K2SO4=BaSO4¯+2KNO3
MgCl2 + 2Na2CO3+H2O=[Mg(OH)]2CO3+CO2+2NaCl
Свойства солей
Растворы солей могут принимать участие в реакциях обмена с кислотами, основаниями и другими солями, если в результате образуется недиссоциирующее соединение (осадок, неустойчивая или летучая кислота, вода). Соли взаимодействуют между собой в растворе, если одна из образующихся новых солей нерастворима или разлагается (полностью гидролизуется) с выделением газа или осадка:
CuSO4+2NaOH=Na2SO4+Cu(OH)2¯
ВаСl2+H2SO4=BaSO4¯+2HCl
Na2CO3+2HCl=2NaCl+H2O+CO2
NaCl(тв)+Н2SO4(ковц)=NaHSO4+HCl
Na2SiO3+2HCl=H2SiO3¯+2NaCl
AgNO3+NaCl=NaNO3+AgCl¯
2AlCl3+3Na2CO3 +3H2O=2Al(OH)3¯+6NaCl+3CO2
Кислые соли вступают в реакции, характерные для кислот, а основные соли вступают в реакции, характерные для оснований. NaHSO4+NaOH=Na2SO4+Н2О (MgOH)Cl+НСl=MgCl2+H2O
Растворы солей вступают во взаимодействие с металлами, если металл находится в ряду напряжений левее металла, образующего катион соли.
CuSO4+Zn=ZnSO4+Cu
CuSO4+Fe=FeSO4+Cu
Соли подвергаются гидролизу. Гидролизоваться могут кислые, средние и основные соли. В некоторых случаях гидролиз может протекать полностью (необратимо) (подробно см. § 16.3.7).
Некоторые соли разлагаются при нагревании. В этих реакциях проявляются свойства характерные как для аниона, так и для катиона. Термическое разложение солей может протекать с изменением и без изменения степеней окисления элементов.
Са(НСO3)2=СаСO3+CO2+H2O
CaCO3=CaO+CO2
KNO3=KNO2+O2
4KClO3=3KClO4+KCl
2AgNO3=2Ag+2NO2+O2
4FeSO4=2Fe2O3+4SO2+O2
Дата добавления: 2016-01-03; просмотров: 2438;
