Краткая характеристика триады железа

Элементы триады железа (железо, кобальт, никель) находятся в побочной подгруппе VIII группы. Остальные элементы VIII группы составляют семейство платиновых металлов, которое включает триады палладия и платины. По свойствам элементы триады железа существенно отличаются от свойств семейства платиновых металлов.
Атомы элементов триады железа имеют на внешнем энергетическом уровне по 2 электрона, которые они отдают в химических реакциях. Однако в образовании химических связей участвуют и электроны 3d-орбиталей второго снаружи уровня (электронные конфигурации валентных орбиталей железа — 3d64s2, кобальта — 3d74s2, никеля — 3d84s2). В своих устойчивых соединениях эти элементы проявляют степени окисления +2, +3. Образуют оксиды состава RO и R2O3. Им соответствуют гидроксиды состава RОН)2 и R(ОН)3.
В обычном состоянии железо, кобальт, никель представляют собой тяжелые серебристо-белые металлы с высокими температурами плавления (см. табл. 33).
Все эти металлы обладают превосходными механическими свойствами — большой прочностью, способностью к прокатыванию, протягиванию, ковке, штамповке.
Металлы семейства железа при нагревании взаимодействуют с кислородом, парами воды, галогенами, серой, фосфором, крем-
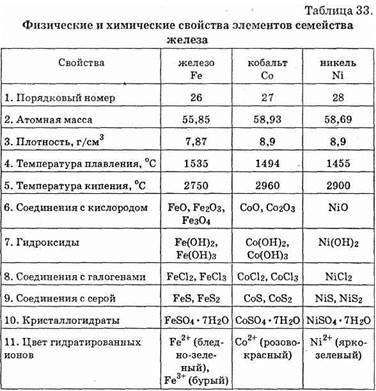
нием, углем и бором (см. табл. 33). Наиболее устойчивыми являются соединения железа (III), кобальта (II) и никеля (II).
Кобальт и никель менее реакционноспособны, чем железо. При обычной температуре они устойчивы к коррозии на воздухе, в воде и в различных растворах. Разбавленная соляная и серная кислоты легко растворяют железо и кобальт, а никель — лишь при нагревании. Концентрированная азотная кислота все три металла пассивирует.
Для элементов триады железа характерно свойство присоединять нейтральные молекулы, например оксиды углерода (II). Карбонилы Ni(CO)4, Со(СО)4 и Fe(CO)5 используют для получения сверхчистых металлов.
Железо, кобальт, никель в ряду стандартных электродных потенциалов расположены до водорода, поэтому распространены в природе в виде соединений (оксиды, сульфиды, сульфаты, кар-
бонаты), в свободном виде встречаются очень редко — в виде железных метеоритов. По распространенности в природе за железом следует никель, а затем кобальт.
Железо, кобальт, никель и их сплавы — весьма важные материалы современной техники. Но наибольшее значение имеет железо.
Железо
Железо — после алюминия самый распространенный в природе металл. Содержание железа в земной коре составляет 4,65%. Основными минералами железа являются следующие:
1) магнетит (магнитный железняк) Fe3O4 содержит до 72% железа — большие месторождения этой руды в нашей стране находятся на Урале;
2) гематит (красный железняк) Fe2O3 содержит до 70% железа, наиболее мощное месторождение — Криворожское;
3) лимонит (бурый железняк) Fe2O3•Н2О содержит до 60% железа, крупные месторождения в Крыму и на Урале;
4) пирит FeS2 содержит примерно 46% железа;
5) сидерит (шпатовый железняк) содержит 48% железа.
Известны другие минералы железа, но менее богатые им. Руды, содержащие менее 45% железа, относятся к бедным рудам и обычно в промышленных целях не используются. Железо входит также в состав животных и растительных организмов. Так, в организме человека железо входит в состав гемоглобина, который является компонентом крови.
Дата добавления: 2016-01-03; просмотров: 5794;
