Дисперсные системы. Коллоидные системы. Растворы. Растворимость
Вещества, растворы которых имеют определенное осмотическое давление, проникают через полупроницаемые перепонки и выделяются из растворов в виде кристаллов. Такие вещества английский ученый Т. Грэм (1805-1869 гг.) назвал кристаллоидами, а их растворы — истинными, в отличие от растворов коллоидных. У коллоидных растворов осмотическое давление незначительно или его нет совсем, и вещества, растворенные в этих растворах, не проникают через полупроницаемые перепонки и не кристаллизуются, т.е. после испарения растворителя остаются в виде бесформенной массы (принимают форму сосуда). Самым известным из таких веществ является клей (по-гречески — колла); поэтому они и были названы коллоидами.
Позднее было обнаружено, что некоторые нерастворимые в воде вещества, будучи очень тонко распыленными (усиленным дроблением или же под влиянием особых причин при их выделении), образуют смеси с такими же свойствами, как и коллоидные растворы; кристаллоиды же при подборе подходящего растворителя также дают коллоидные растворы. Поэтому в настоящее время название коллоид (кристаллоид) применяется только к веществам, известным лишь в коллоидном (кристаллоидном) состоянии. В других случаях говорят о коллоидном состоянии вещества, а не околлоидных веществах.
Часть химии, которая занимается изучением веществ в коллоидном состоянии, называется коллоидной химией. Рассмотрим ее основу на примере. Графит не растворяется в масле. Если же размешать порошок графита в масле, то образуется смесь — суспензия, которая по истечении некоторого времени разделится, т.к. графит осядет на дно сосуда. Если графит, измельченный до пылевидного состояния, рассеян в масле, то он не дает осадка, т.е. получится коллоидный раствор графита в масле. Точно так же
можно жидкость (например, масло) рассеять в другой жидкости (например, в воде) в эмульсию, которая хотя и разделится через некоторое время, однако при определенных условиях становится коллоидным раствором масла в воде.
Общее название суспензии, эмульсии, коллоидных и истинных растворов — дисперсоиды, или дисперсные системы.
Дисперсная фаза системы — раздробленное вещество, дисперсная среда — жидкость.
Известны дисперсоиды твердые и газообразные, как это видно из разделения их по группам дисперсной среды:
1. Дисперсоиды газообразные: дым, туман (твердые вещества или жидкости, рассеянные в газовой среде).
2. Дисперсоиды жидкие:
а) пирозоли (устойчивы при высокой температуре), например рассеянные металлы в расплавленных солях;
б) криозоли (устойчивы при низкой температуре), например лед в хлороформе;
в) лиозоли (устойчивы при обыкновенной температуре), например коллоидные растворы — суспенсоиды и эмульсоиды.
I. Дисперсоиды твердые: цветное стекло, опалы и некоторые сплавы металлов.
Чаще всего в химии мы встречаемся с лиозолями, которые делятся по степени дисперсности:
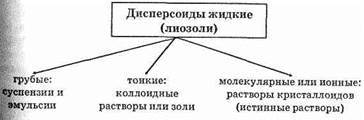
Коллоидные растворы составляют переход между суспензиями (эмульсиями) и истинными растворами. Все зависит здесь от величины частичек дисперсной фазы, т.е. от степени дисперсности (рассеивания) дисперсной фазы.
Величина рассеянных частиц от 10-4 до 10-8 см.1
1 микрон = 1m=10-4 см
1миллимикрон=1mm=10-7см.
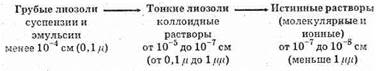
Таким образом, коллоидность не является свойством каких-либо определенных веществ, но является общим свойством всех веществ, т.к. каждое вещество (твердое, жидкое или газообразное) можно привести в коллоидное состояние в подходящей среде при достаточном размельчении.
Так, например, поваренная соль NaCl — кристаллоид (образует с водой истинный раствор). Коллоидный раствор NaCl можно получить при достаточном рассеянии NaCl в бензине.
Дисперсные системы неустойчивы. Уменьшением степени дисперсности, т.е. увеличением размера частичек, коллоидное состояние нарушается, и частицы оседают. В этом случае коллоидный раствор коагулирует, т.е.образуется суспензия или гель (желатинообразное вещество), связывающие большую часть дисперсной среды, т.е. растворителя.
Твердые, жидкие и газообразные системы (смеси) двух или нескольких компонентов, образующих одну фазу (гомогенные), называются растворами.
По агрегатному состоянию различают растворы газообразные (газовые смеси, например воздух), растворы жидкие (растворы газов, жидкостей и твердых веществ в жидкостях) и твердые растворы (сплавы, стекло).
Истинные растворы сострят из растворенного вещества, находящегося в виде атомов, ионов иди молекул, равномерно окруженных атомами, ионами или молекулами растворителя. То есть истинные растворы однофазны, в них отсутствует граница раздела между растворителем и растворенным веществом.
Огромное значение имеют жидкие смеси, в которых растворителем является жидкость. Общепринятым растворителем является вода, но применяются и другие растворители, например спирт, эфир, ацетон, бензин, пиридин и т.д.
Итак, в процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием движущихся частиц растворителя переходят в раствор, образуя качественно новую однородную систему.

В зависимости от способности растворяться вещества делятся на хорошо растворимые в воде, малорастворимые в воде и практически нерастворимые в воде.
Например, практически нерастворимы в воде: благородные газы, золото; малорастворимы в воде: оксид азота (II), азот, кислород, гидроксид кальция; хорошо растворимы в воде: нитраты (соли азотной кислоты), аммиак и т.д.
Растворимость веществ зависит от температуры, давления, от природы растворителя и растворимых веществ, от присутствия в растворах посторонних веществ.
Остановимся на зависимости растворимости веществ от температуры и природы растворителя.
Растворимость твердых веществ в воде, как правило, увеличивается с повышением температуры.
При определенной температуре при растворении твердого вещества концентрация его в растворе растет. Одновременно происходит и обратный процесс — выделение твердого вещества из раствора — кристаллизация вещества. Если система находится в состоянии динамического равновесия, то скорости прямого и обратного процессов одинаковы, а концентрация растворенного вещества неизменна. Такое состояние системы может сохраняться долго, пока не изменятся условия течения процесса растворения. Раствор, в котором достигается равновесие, называется насыщенным. Кроме насыщенных, различают ненасыщенные растворы. Это растворы, содержащие при заданной температуре меньше растворенного вещества, чем должен содержать насыщенный раствор.
При быстром охлаждении насыщенного раствора может произойти образование пересыщенного раствора. Пересыщенным называют раствор, в котором при данной температуре содержится большее количество вещества, чем в насыщенном растворе. Пересыщенный раствор неустойчив, и при изменении условий (при встряхивании и т.п.) выпадет осадок, над которым остается насыщенный раствор.
Растворимость газов увеличивается при понижении температуры. При изменении давления растворимость газа в жидкости подчиняется закону Генри:

Эту закономерность выражают формулой: x=kp
где x — мольная доля растворенного вещества, p — давление, k — постоянная величина (константа Генри).
Дата добавления: 2016-01-03; просмотров: 2083;
