Вегетационные опыты с песчаной и водной культурой
В опытах с песчаной культурой субстратом является песок, с водной – дистиллированная, бидистиллированная, иногда водопроводная вода. Песок и вода в отличие от почвы – бесплодные среды и их применяют, чтобы создать при изучении питания растений строго контролируемые условия.
С помощью песчаной культуры определяют, какие элементы необходимы растениям, какова роль каждого элемента, устанавливают их оптимальное соотношение, формы и дозы внесения, изучаются явления антагонизма и синергизма различных элементов и др. В опытах используют кварцевый или белый речной песок с частицами от 0,2 до 0,5 мм, отмытый от илистых частиц. Когда в опыте нужна особо чистая среда, песок 3–5 дней выдерживают в концентрированной соляной кислоте, после чего промывают сначала водопроводной, а затем дистиллированной водой до отрицательной реакции на хлор (с AgNO3).
Для зерновых, трав, бобовых используют сосуды, вмещающие 4–8 кг песка, для корнеплодов и клубнеплодов – 10–20 кг. Техника закладки и проведения опытов с песчаной культурой такая же, как и с почвенной, с той только разницей, что в песчаную культуру питательные элементы вводят с питательной смесью.
Питательная смесь содержит все необходимые элементы питания в усвояемой форме (соли) и в количествах, достаточных для нормального роста и развития растений. Питательная смесь должна обеспечивать физиологическую уравновешенность раствора и оптимальную, желательно нейтральную, реакцию на протяжении вегетационного периода. Существует множество разнообразных по составу питательных смесей, отличающихся набором солей, реакций, концентрацией питательных элементов. Приведем некоторые универсальные питательные смеси для песчаных и водных культур (соли, отмеченные звездочкой, лучше растворять отдельно, так как они образуют осадок).
Смесь Гельригеля (г/л): Ca(NO3)2 безводный* – 0,492 или Ca(NО3)2 ∙ 4Н2О – 0,708; FeCl3∙6Н2О – 0,025; КС1 – 0,075; КН2РО4* – 0,136; MgSO4 безводный – 0,060 или MgSO4∙7H2O – 0,123.
Смесь Кнопа (г/л): Ca(NO3)2 безводный* – 1,00 или Ca(NО3)2∙4Н2О – 1,44; FeCl3∙6H2О (5%-ный раствор) – 1 капля; KH2PO4*– 0,25; КС1 – 0,12; MgSО4 безводный – 0,25 или MgSО4 ∙7H2О – 0,51.
Смесь Гильтнера (г/л): KNO3 – 0,0368; NaNO3 – 0,0512; (NH4)2НРО4 – 0,25; Fe3(PО4)2∙4H2О – 0,25; (NH4)2SO4 – 0,064; MgSО4∙7H2О – 0,25; KC1 – 0,25; FeCl3- (3,5%-ный раствор) – 3 капли.
Смесь Прянишникова (г/л): NH4NО3 – 0,24; СаНРО4 – 0,172; FeCl3∙6Н2О – 0,025; CaSО4∙2H2О – 0,344; MgSО4 безводный – 0,060 или MgSО4∙7H2О – 0,123; КС1 – 0,160.
Смесь Белоусова для сахарной свеклы (г/л): Ca(NO3)2 –1,1; КН2РО4 – 0,36; К2НРО4 – 0,43; MgSO4 безводный – 0,054; FeCl3 – 0,010; NaCl – 0,1; Н3ВО3 – 0,005; MnSО4∙5H2О – 0,005.
Смесь Ягодина для гречихи (мг/л): NH4NО3 – 343; КН2РО4 – 263; K2SО4 – 166; Fe(SO4)3∙9H2О – 40; MgSO4∙7Н2О – 716; Н3ВО3 – 2,86; CuSO4∙5H2О – 0,197; ZnSО4 – 0,44; MgSO4∙5H2O – 2,63; CaSO4∙7H2O – 0,095; NaMoО4∙2Н2О – 0,77; СаСО3 – 500,5; СаСО3 (дополнительно через 20 дней) – 55,5.
Смеси Кнопа, Гельригеля составлялись главным образом эмпирически, Прянишникова, Белоусова, Ягодина – на основании теоретических предпосылок.
Главные отличия между питательными смесями состоят в выборе источников азота и фосфора, влияние которых на реакцию раствора должно быть уравновешено. Если в состав смеси входит аммонийная соль (физиологически кислая), то смесь со временем будет подкисляться, а если Ca(NO3)2 – подщелачиваться. Однозамещенные фосфаты (КН2РО, NaH2PO и др.) обладают буферным свойством против подщелачивания, а двухзамещенные [К2НРО4, Na2HPO4, СаНРО4, а также Са3(РО4)2] – против подкисления. Так, в смесь Гельригеля азот введен в форме Ca(NО3)2 – соли физиологически щелочной, а КН2РО4 служит буфером против подщелачивания.
Устойчивую реакцию среды сохраняют питательные смеси Прянишникова и Белоусова, включающие труднорастворимые соли. При использовании хорошо очищенной воды и питательных смесей, в состав которых первоначально не включены микроэлементы, в раствор добавляют микроэлементы. Растворы микроэлементов по Хоклэнду для универсальных питательных смесей готовят из 18 мл воды и следующих солей: Н3ВО3 – 11 г; МпС12∙5Н2О – 7; CuSO4∙5Н2О, ZnSO4, A12(SО4)3, NiSO4∙6Н2О – по 1 г; Co(NO3)2∙6Н2О, ТiО2 – по 1 г; LiCl, SnCl2∙2Н2О, Kj, KBr – по 0,5 г. Раствор микроэлементов добавляют по 1–1,5 мл к 1 л питательной смеси или песка.
В качестве водной культуры обычно используется дистиллированная вода и лишь в специальных опытах бидистиллированная. Вода по сравнению с песком более чистый субстрат, но опыты с водной культурой более трудоемки. Эту модификацию вегетационного опыта применяют при изучении периодичности питания растений (для определения оптимальных условий в разные периоды вегетации), особенностей развития корневых систем, влияния реакции и буферности питательной среды на развитие растений.
Опыты с водной культурой проводят в широкогорлых стеклянных или полиэтиленовых сосудах вместимостью 3–5 и более литров, закрытых пробками с отверстиями, в которых растения закрепляются с помощью ватных тампонов или других приспособлений. Крепится каркас, через него пропускают трубки для насыщения питательного раствора воздухом (рис. 15.10). Удобно закреплять растения в широких цилиндрах из пластмассы или других нержавеющих материалов с сетчатым дном, наполненных гравием или гранулированным полиэтиленом. Способы укрепления растений в водной культуре показаны на рис. 15.11. Сосуды наполняются водой на три четверти объема.
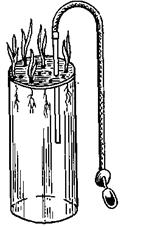
Рис. 15.10. Стеклянный вегетационный сосуд для водной культуры с трубкой и грушей для насыщения воды воздухом.
В опытах с водной культурой готовят питательные растворы высокой концентрации (в 100–200 раз выше, чем нормальной питательной смеси) и вносят их пипеткой или мерным цилиндром по схеме опыта. Семена проращивают в кюветах с песком, опилками, фильтровальной бумагой. Когда у растений образуются корни длиной 6–7 см, их закрепляют в крышке вегетационного сосуда. Во избежание перегрева сосудов и появления водорослей на сосуды надевают двойные чехлы (темные внутри и светлые снаружи).
Уход за растениями в опытах с водной культурой включает аэрацию питательного раствора. Резиновой грушей или воздуходувкой воздух продувают через воду один-два раза в сутки по 5–10 мин. Аэрация необязательна, если корни не полностью погружены в раствор (примерно на две трети). В соответствии со схемой опыта 3–4 раза за вегетацию питательные растворы меняют. 2–3 раза в неделю определяют реакцию питательного раствора и добавляют щелочные или кислотные растворы, чтобы значение рН находилось в нужных пределах. По мере испарения жидкости в сосуды доливают дистиллированную воду.
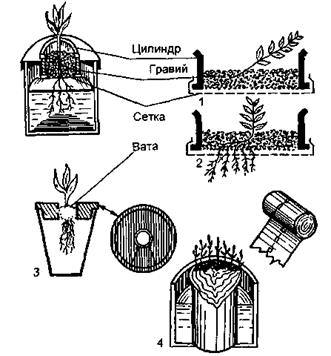
Рис. 15.11. Способ закрепления растений в водной среде:
1 – в момент посадки; 2 – после укоренения; 3 – кружок из парафинированного
дерева; 4 – питательная среда из фильтровальной бумаги.
Убирают и учитывают урожай в опытах с водной культурой так же, как с почвенной, но кроме основной и побочной продукции учитывается масса корней, анализируются части растений. Данные опыта статистически обрабатывают.
Метод изолированного питания, или разделенной культуры, используется при изучении значения разных солей в питании растений, передвижения элементов питания по корневой системе, выделения питательных элементов растениями, влияния внешних условий (температуры, реакции и др.) на питание растений, влияния взаимодействия двух или нескольких солей на усвоение элементов питания. В опытах с разделенной культурой растения одновременно выращивают на двух субстратах. Для этого один сосуд помещают в другой и заполняют их разными субстратами. Проростки растений закрепляют так, чтобы одна прядь корней растения получала питание из внешнего сосуда, другая – из внутреннего. Этот метод называют еще методом «всадника» – растение «сидит» на стенке внутреннего сосуда, как всадник на лошади (рис. 15.12). В опытах с изолированным питанием в качестве субстрата используются песчаные, песчано-почвенные, водные и другие культуры с нормальными или измененными питательными смесями.
Метод текущей песчаной культуры, или протекающих растворов (капельная культура по Демолону), применяется, когда для исследования надо иметь постоянную концентрацию элементов или постоянное соотношение элементов, а также стабильную реакцию среды. В опытах с текущей песчаной культурой питательный раствор из бутылей вместимостью 16–20 л, помещенных на верхней полке установки, с помощью сифона подается в промежуточный сосуд, откуда он под постоянным давлением через сифоны с кранами или зажимами поступает в сосуды с растениями на нижней полке установки (рис. 15.13). Раствор проходит через песок, омывает корни и вытекает из отверстия в нижней части сосуда. При набивке сосудов питательная смесь в песок не вносится. Питательные смеси (Кнопа, Гельригеля и др.) разбавляют в 5–10 раз и пропускают через сосуды с растениями со скоростью 4 л в день – такой скорости достаточно, чтобы полностью обновить раствор в сосудах и поддерживать на одном уровне состав и реакцию питательной среды.
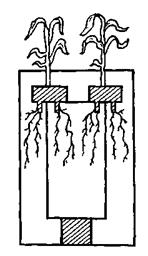
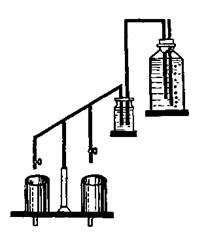
| Рис. 15.12. Метод изолированного питания. | Рис. 15.13. Метод текущей песчаной культуры. |
В опытах со стерильной культурой изучаются роль микроорганизмов в питании растений, корневые выделения, питание растений органическими соединениями. Эта модификация вегетационного опыта очень сложна, так как в сосудах субстрат и корневая система должны быть стерильными. Надземная часть растений находится в обычных условиях (рис. 15.14). Стеклянную посуду и песок стерилизуют при температуре 150 °С в течение двух часов, для обработки семян и материалов, не выдерживающих нагрева, используют антисептики (спирт и др.). Опыты со стерильной культурой ставятся редко, поэтому на технике их проведения мы останавливаться не будем.
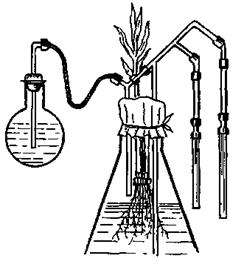
Рис. 15.14. Стерильная культура.
Дата добавления: 2015-12-29; просмотров: 2552;
