Бинарные смеси со взаимно растворимыми компонентами.
Бинарные смеси (растворы) со взаимно-растворимыми компонентами. Растворы из полностью растворимых друг в друге жидкостей делятся на подчиняющиеся закону Рауля (идеальные) и имеющие, как это будет показано ниже, положительное или отрицательное отклонение от закона Рауля (растворы с минимальной и максимальной температурами кипения).
Закон Рауля гласит, что парциальное давление пара каждого компонента в паровой смеси над кипящей при какой-либо температуре жидкой смесью равно давлению насыщенного пара этого компонента. кипящего в чистом виде при той же температуре, умноженному на молекулярную долю этого компонента в жидкой смеси.
Под молекулярной долей компонента подразумевается отношение числа молей его в смеси к суммарному числу молей обоих компонентов. Если в бинарной смеси 'вещество с молекулярным весом μа находится в количестве а, %' от массы, а вещество с молекулярным весом μв в количестве b, %', то молекулярные доли компонентов смеси определяются по формулам: ХА =(а/ μА )/( а/ μА + b/ μБ) (5-4а)
ХБ=( b/ μА)/( а/ μА + b/ μБ) (5-4б)причем ХА + ХБ =1
Молекулярные доли можно выражать также в процентах. Число моль - процентов компонента получается умножением формулы(5-4а) или (5-46)
 Математически закон Рауля можно выразить в виде: pА= РА ХА (5-5)
Математически закон Рауля можно выразить в виде: pА= РА ХА (5-5)
где pа—парциальное давление пара компонента а над кипящей смесью;
Ха — молекулярная доля этого компонента в жидкой смеси; Ра —давление насыщенного пара компонента а при температуре кипения смеси.
Аналогичное уравнение для компонента и рБ= РБ (1-ХА ) (5-5а)
Если Р обозначает суммарное давление, то: Р = рБ + рА = РА ХА+ РБ (1-ХА ) (5-6)
Обозначим через уа молекулярную долю компонента а в парах или паровой фазе. Величина уа равна отношению парциального давления компонента а к суммарному давлению, можно написать: уа = рА/( рБ + рА)= РА ХА/(РА ХА+ РБ(1-ХА ) )=РА ХА/Р(5-7)
Уравнение (5-7) может быть. выражено в виде:уА/ ХА=РА/(РБ+ХА(РА+РБ))(5-7а)
Если РА >РБ, т. е. а является летучим компонентомсмеси, то: в.этом случае у/х>1 или у>х, т. е. содержание летучего компонента в парах всегда больше содержания его в жидкости.
Если же РА <.РБ. т. .е. а является нелетучим компонентом.
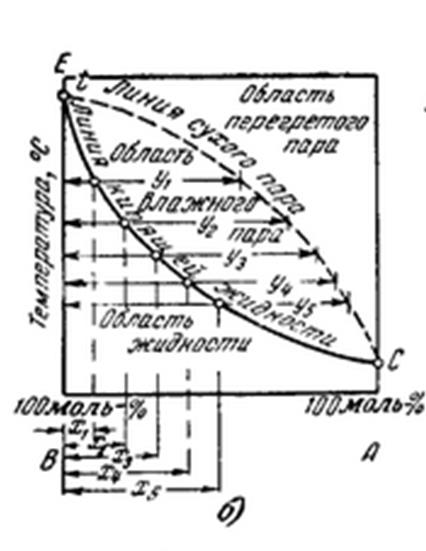
Графическое изображение связи между температурой кипения жидкой смеси, составом жидкости и составом получающихся паров при заданном давлении, фазовой диаграммой, приведено на рис.. По оси ординат этого графика отложена температура смеси, а по оси абсцисс—молекулярные доли компонентов в жидкой и паровой фазах. Зависимость между температурой кипения жидкой смеси и ее составом изображается нижней линией, называемой кривой кипения или кипящей жидкости. Состав получающихся паров в зависимости от температуры кипения изображается верхней пунктирной кривой, эту кривую называют линией сухого пара. Из диаграммы ясно, что содержание легко кипящего компонента в парах больше, чем в жидкости (у>х). Точки Е и С соответствуют температурам кипения частых компонентов при заданном давлении.
ЕС (верхняя) линия сухого пара, зависимость между температурой кипения жидкой смеси и составом образующихся паров (линия конденсации).
ЕС (нижняя) линия кипящей жидкости. Показывает зависимость между температурой кипения жидкой смеси и ее составом.
 Для большинства растворов диаграмма кипения и конденсации, или фазовая диаграмма, строится по опытным данным. Однако построение кривых кипения и конденсации сухого пара может быть произведено на основании закона Рауля, если известна зависимость температуры кипения чистых компонентов от давления. В этом случае для любой промежуточной температуры между точками Е и С могут быть найдены давления РА и РБ паров обоих компонентов, кипящих в чистом виде. Из уравнения (5-6) следует, что
Для большинства растворов диаграмма кипения и конденсации, или фазовая диаграмма, строится по опытным данным. Однако построение кривых кипения и конденсации сухого пара может быть произведено на основании закона Рауля, если известна зависимость температуры кипения чистых компонентов от давления. В этом случае для любой промежуточной температуры между точками Е и С могут быть найдены давления РА и РБ паров обоих компонентов, кипящих в чистом виде. Из уравнения (5-6) следует, что
Ха =(Р-РБ )/ (РА - РБ ) – кривая кипения
Определив х для разных температур, можно построить кривую кипения. УА = РА ХА/Р = РА(Р- РБ )/Р(РА - РБ ) - кривая пара
Определив У для разных температурможно построить кривую конденсации сухого пара.
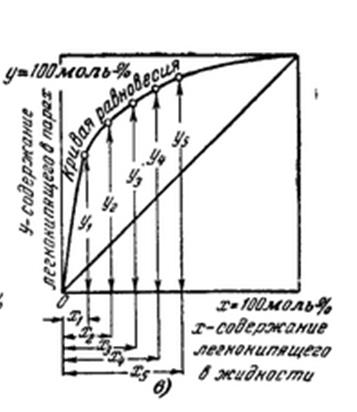
Зависимость состава пара от состава жидкости отражает кривая равновесия для бинарной смеси.
Дата добавления: 2015-12-29; просмотров: 2152;
