Транскрипция и трансляция
«Мост» между геном (кодонами) и белком обеспечивается РНК. Точнее, информация, закодированная в последовательности азотистых оснований ДНК, вначале переносится от ДНК к матричной РНК (мРНК). Этот этап переноса информации носит название транскрипции и происходит у прокариотов в нуклеоиде, а у эукарио-тов — в ядре. Что же касается перевода информации с мРНК в белки, то этот этап декодирования получил название трансляции.
Транскрипция — первый этап в передаче генетической информации, сущность которого заключается в синтезе мРНК, т. е. в«перепи-сывании» генетической информации в молекулы мРНК (рис. 136). Транскрипция начинается с фиксированного пункта и заканчивается также в фиксированном пункте. Основными структурами, которые участвуют в транскрипции, являются ДНК-матрица (цепь ДНК), РНК-полимераза и хромосомные белки (гистоновые и неги-стоновые).
Молекулы мРНК составляют около 3% общей клеточной РНК. Они очень нестабильны. Период их полужизни очень краток. У прокариотов он составляет 2—10 минут, у млекопитающих и человека — около 12-16 часов, у некоторых других эукариотов — даже несколько недель. У прокариотов молекулы мРНК являются непосредственными продуктами транскрипции. Напротив, у эукариотов они являются продуктами процессинга первичных РНК-транскриптов (см. ниже).
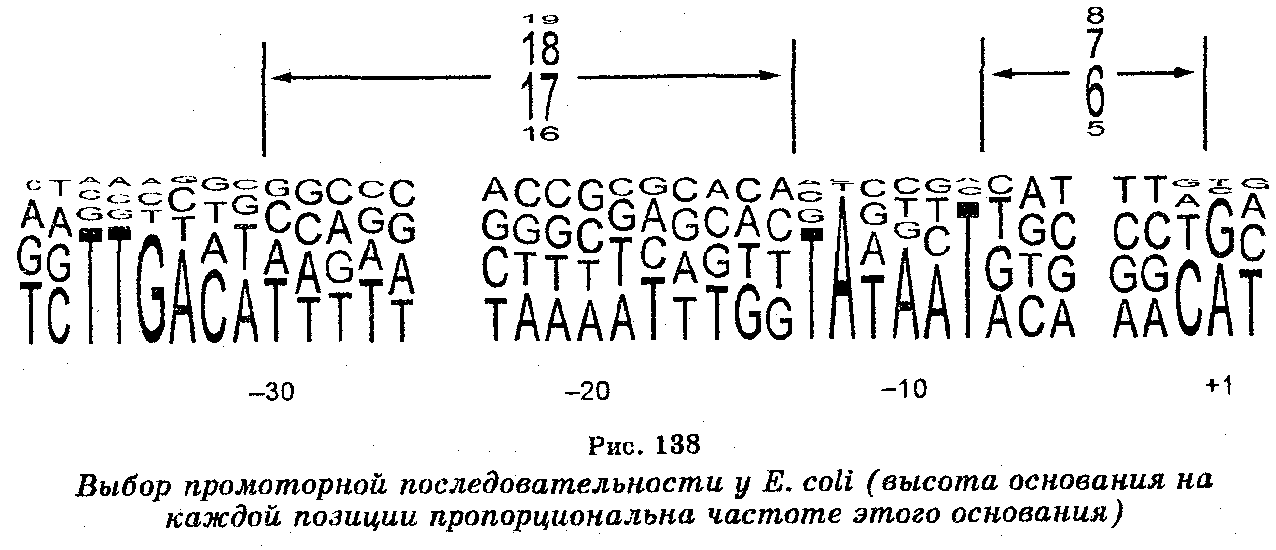
Синтез молекул мРНК происходит в ядре клетки и очень сходен с репликацией ДНК. Отличие заключается лишь в том, что в качестве матрицы (шаблона) для копирования цепи мРНК используется лишь одна цепь ДНК. При этом копирование мРНК может начаться с любого пункта одиночной цепи ДНК, к которому прикрепляется РНК-полимераза и который называют промотором. Однако возможны случаи, когда два даже соседних гена могут транскрибироваться с разных цепей. Таким образом, для транскрипции может быть использована любая из двух цепей ДНК (рис. 137), но в любом случае одна из цепей транскрибируется одними РНК-по-лимеразами, другая — другими РНК-полимеразами, причем выбор цепи ДНК для транскрипции определяется промоторной последовательностью, которая задает направление движения РНК-полиме-разы (рис. 138).
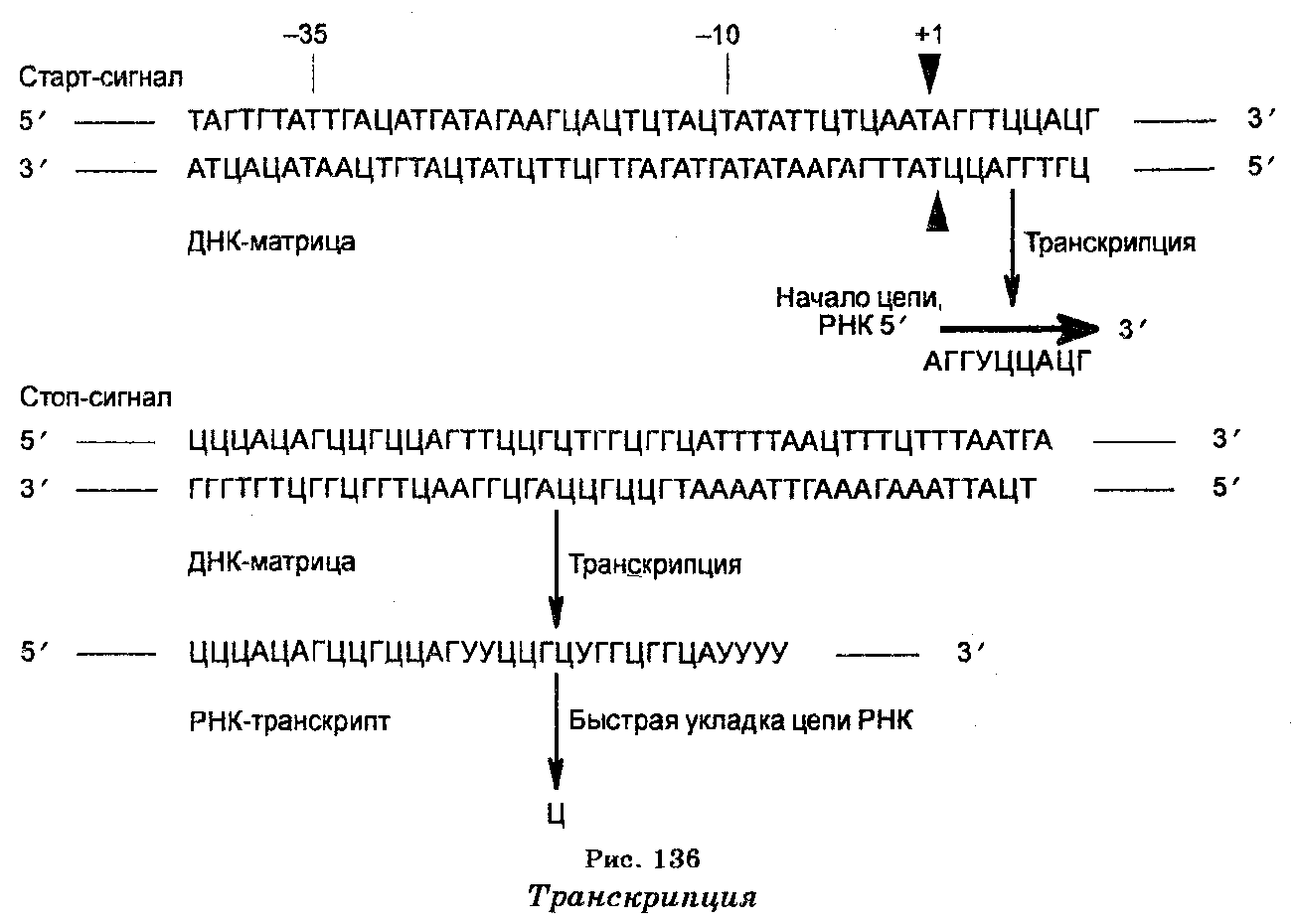
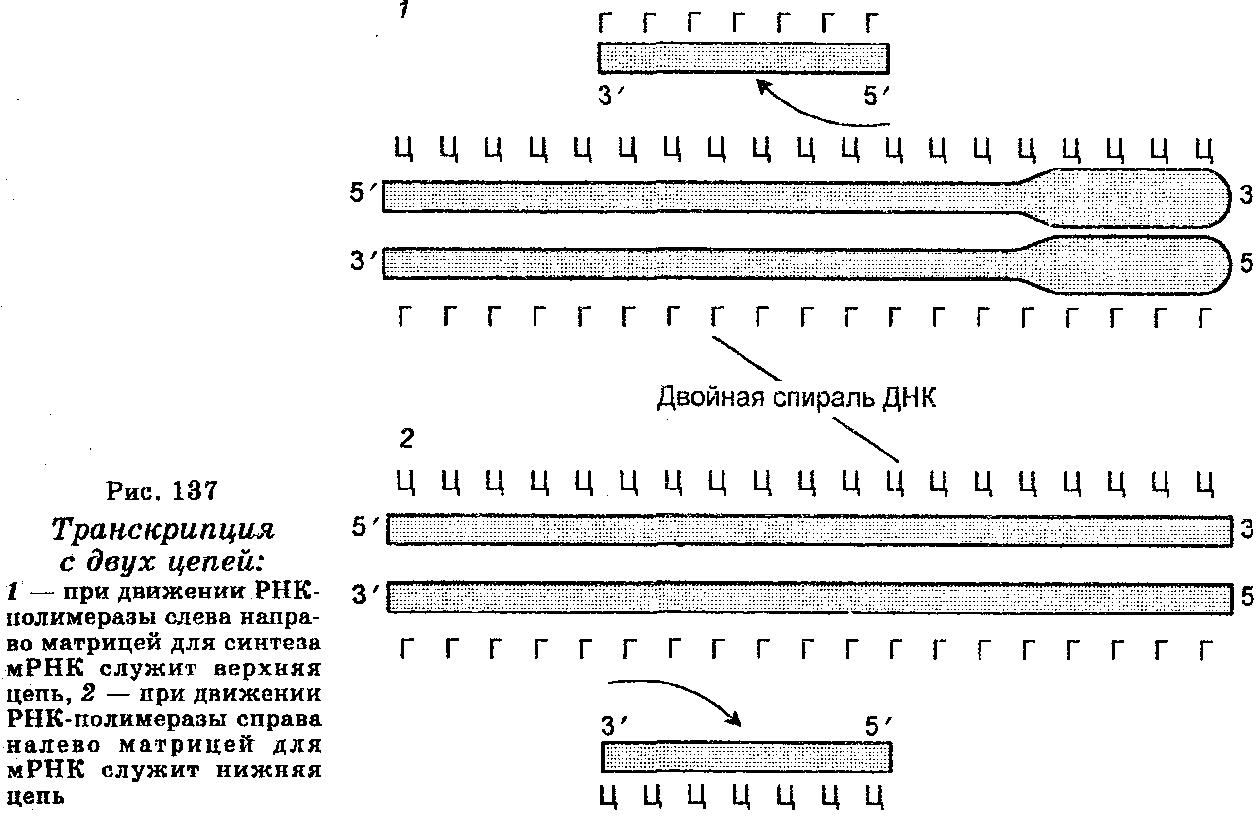
Поскольку обе цепи ДНК имеют противоположную полярность, а цепи РНК растут лишь в направлении от 5'-конца к 3'-концу, то транскрипции на каждой из цепей ДНК проходят в противоположных направлениях. Выбор цепи ДНК для транскрипции определяется содержанием последовательностей на ее промо-торных участках (местах присоединения РНК-полимеразы). Цепь, которая содержит те же последовательности, что и мРНК, называют кодирующей, а цепь, обеспечивающую синтез мРНК (на основе комплементарного спаривания) — антикодирующей. Из-за считывания кода с мРНК для его записи используют основания не А, Г, Т, Ц, а А, Г, У, Ц. Далее, мРНК не остается комплементарно связанной с ДНК-шаблоном, т. к. она освобождается от ДНК, которая затем восстанавливает свою двойную структуру. Наконец, молекулы мРНК значительно короче цепи шаблона ДНК. В одной эукаритической клетке количество молекул мРНК доходит до 10 000 и более.
Однако наряду с молекулами мРНК на ДНК образуются и другие транскрипты. В частности, транскрибируются молекулы рибо-сомной и транспортных РНК, которые также имеют важное значение в реализации генетической информации. Все эти РНК называют еще ядерными. Размеры транскриптов (транскрибируемых молекул РНК) зависят от посылаемых с цепи ДНК-шаблона сигналов начала и остановки синтеза (кодонов инициации и терминации).
Наиболее обильными РНК в клетках всех видов являются молекулы рибосомной РНК (рРНК), которые выполняют роль структурных компонентов рибосом. У эукариот синтез рРНК контролируется огромным количеством генов (сотни-тысячи копий) и происходит в ядрышке. В клетках человека гены для рРНК локализованы на 13, 14, 15, 21 и 22 парах хромосом.
В меньших количествах в клетках обнаруживаются молекулы транспортных РНК (тРНК), которые участвуют в декодировании информации (трансляции).
Все РНК транскрибируются с ДНК, которая несет множественные копии соответствующих генов. Непосредственными предшественниками в синтезе РНК являются рибонуклеозидтрифосфаты, причем здесь действует то же правило спаривания оснований за исключением того, что кодируются лишь ограниченные сегменты цепи ДНК и что тимин в ДНК заменяется на урацил в РНК. Ура-цил спаривается с аденином таким же образом, как и тимин. Цепь РНК растет в направлении от 5'- к 3'-концу с освобождением пирофосфата.
Синтез РНК обеспечивается РНК-полимеразами. У прокариот синтез мРНК, рРНК и тРНК осуществляет лишь один тип РНК-полимеразы, количество молекул которой в клетках достигает до 3000 молекул. Каждая из молекул этой РНК-полимеразы состоит из шести полипептидов, какими являются субъединицы р' и (3 (м. м. 155 ПОО и 151 000 соответственно), двух субъединиц а м. м. 36 000 и еще двух низкомолекулярных субъединиц (8 и ю). Инициация транскрипции обеспечивается субъединицей 5 — РНК-полимеразы, которая является, по существу, фактором инициации транскрипции. Как отмечено выше, связывание РНК-полимеразы с ДНК происходит на участке, называемом промотором и содержащем старт-сигнал для синтеза РНК, и контролируется белковым фактором. У Е. coli промоторы содержат последовательность ТАТААТ (бокс Прибнау), отстоящую от сайта начала транскрипции мРНК на расстояние в шесть оснований. После присоединения к промотору РНК-полимераза раскручивает в этом участке двойную спираль ДНК, обнажая цепи, каждая из которых служит затем матрицей, на которой происходит спаривание комплементарных оснований ДНК и рибонуклеозидтрифосфатов. Как только произошло спаривание двух первых мономеров РНК-полимераза продвигается дальше, обнажая дальнейшие участки цепей ДНК и добавляя последующие мономеры РНК. Удлинение цепи РНК происходит до тех пор, пока РНК-полимераза на своем пути не встретит «стоп-сигнал» и не отделится затем как от ДНК-шаблона (матрицы), так и РНК.
Напротив, в клетках эукариот (в частности, у дрожжей и человека) существуют три РНК-полимеразы (I, II, III), представляющие собой сложные молекулы, содержащие по нескольку полипептид-ных цепей. Каждая из этих РНК-полимераз, прикрепляясь к про-мотору на ДНК, обеспечивает транскрипцию разных последовательностей ДНК. РНК-полимераза I синтезирует крупные рРНК (основные молекулы РНК больших и малых субъединиц рибосом). РНК-полимераза II синтезирует все мРНК и часть малых рРНК, РНК-полимераза III синтезирует тРНК и РНК 5з-субъединиц рибосом. Количество РНК-полимераз в клетках млекопитающих различно (около 40 000 молекул РНК-полимераз I и II и около 20 000 молекул РНК-полимеразы III на клетку).
Эукариотические РНК-полимеразы также характеризуются сложным строением. РНК-полимераза II многих организмов построена из 12 различных полипептидов, три из которых гомологич-ны субъединицам р', р и а РНК-полимеразы Е. coli. РНК-полимеразы I и III обладают 5 субъединицами, сходными с субъединицами РНК-полимеразы II. РНК-полимераза II инициирует транскрипцию, причем для этого требуется белок ДНК-геликаза, детерминируемая у дрожжей геном RA25, а у человека — геном XRB. Большинство эукариотических промоторов содержат последовательность ТАТА, локализованную на расстоянии от 30 до 120 оснований от сайта транскрипционного сайта. У эукариотов для связывания РНК-полимеразы с промотором необходимы специальные белки, выполняющие функцию факторов инициации транскрипции (TF I, TF II, и TF III для РНК-полимераз I, II и III соответственно).
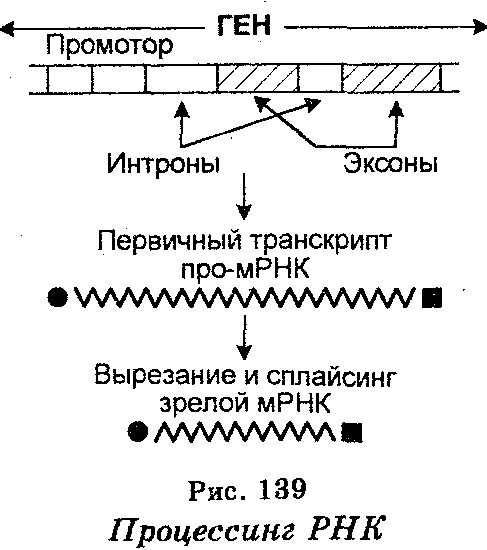
Транскрипция у эукариот является более сложным процессом по сравнению с транскрипцией у прокариотов. Длина последовательностей РНК (транскриптов), синтезируемых той или иной РНК-полимеразой, доходит до 50 000 нуклеотидов и более, причем за одну секунду они удлиняются на 30 азотистых оснований. Однако будучи точными копиями транскрибируемых генов, формируемые первичные транскрипты являются гетерогенными, т. к. не на всем протяжении способны к трансляции. По этой причине транскрипты называют гетерогенной ядерной РНК (гяРНК) или про-мРНК.
Для того чтобы про-мРНК стала «зрелой» мРНК, она еще в ядре вовлекается в процессинг, который заключается в том, что из про-мРНК с помощью ферментов «вырезаются» нетранслируемые участки (интроны), после чего транслируемые участки (эксоны) воссоединяются (рис. 139). Воссоединение называют сплайсингом (от англ. splice — сращивать). В результате процессинга образуются непрерывные последовательности зрелой мРНК, которые по своим размерам значительно меньше молекул про-мРНК, т. е. являются более короткими (табл. 20). Молекулы гяРНК содержит обычно более 50 000 нуклеотидов, тогда как после сплайсинга мРНК содержит всего лишь 500-3000 нуклеотидов.
Подсчитано, что гяРНК составляет половину всей клеточной РНК, тогда как на долю зрелой мРНК приходится лишь 3% клеточной РНК.
Размеры интронов составляют обычно 80—1000 азотистых оснований.
 Биохимические механизмы сплайсинга определяются участием в этом процессе малых гетерогенных ядерных рибонуклеопроте-иновых частиц (sm RNP). Таких частиц выявлено несколько (V^, Ug, U^, Ug и другие), каждая из которых содержит по 90-150 нуклеотидов и по 10 разных белков. Все эти структуры контролируются в интерфазном ядре, причем их концентрация контролируется одной из киназ.
Биохимические механизмы сплайсинга определяются участием в этом процессе малых гетерогенных ядерных рибонуклеопроте-иновых частиц (sm RNP). Таких частиц выявлено несколько (V^, Ug, U^, Ug и другие), каждая из которых содержит по 90-150 нуклеотидов и по 10 разных белков. Все эти структуры контролируются в интерфазном ядре, причем их концентрация контролируется одной из киназ.
Один и тот же транскрипт РНК может подвергаться разному сплайсированию, в результате чего сплайсированные участки зрелой мРНК могут кодировать разные белки, что свидетельствует в пользу эволюционного значения этой реакции.
Помимо модификации ядерной про-мРНК путем «вырезания» и сплайсинга ее сегментов нередко имеет место так называемое «редактирование» РНК, которое заключается в конверсии одного основания в другое в мРНК. Например, в клетках печени синтезируемый белок аполидопротеин имеет молекулярную массу порядка 512 000 дальтон, а в клетках кишечника лишь 242 000. Это является результатом конверсии цитозина в урацил (в клетках кишечника), что ведет к образованию стоп-кодона, а, следовательно, и к синтезу более короткого белка. Наконец, возможна модификация мРНК и путем посттранскрипционного добавления к ее 3'-концу от 30 до 500 нуклеотидов полиадениловой кислоты на расстоянии 15 нуклеотидов от последовательности ААУААА. По этой причине транскрипций заканчивается вдали от полиА-сигнала, а процессинг удаляет экстрануклеотиды перед полиА-добавлением (полиаденозином).
Синтезированная зрелая мРНК является первичным продуктом действия генов. В случае Е. coil после формирования она переходит затем из ядра в цитоплазму и на рибосомы, на которых спаривается с рРНК рибосомной субъединицы 30 S. Последовательность мРНК, которая связывается с рРНК рибосомной субъединицы 16 S, получила название последовательность Шайно-Дальгарно. Здесь мРНК служит матрицей для формирования полипептидных цепей на рибосомах. Считают, что в клетках имеется по 2000-3000 молекул мРНК, находящихся на разных уровнях синтеза и распада. В частности, установлены рибозимы с полинуклеотидкиназной активностью, способные катализировать АТФ-зависимое фосфорили-рование (см. гл. X).
Молекулы рРНК и тРНК также являются продуктами процессинга.
Открытие интронов поставило вопрос об их происхождении. В объяснении их происхождения используют две гипотезы. В соответствии с одной гипотезой интроны были представлены уже в предковых генах, в соответствии с другой интроны были включены в гены, которые оригинально были непрерывными.
Таблица 20
Результаты процессинга первичных генных транскриптов
| Ген | Длина гена | Длина мРНК | Количество интронов |
| Р-глобин | 1,5 | 0,6 | |
| Инсулин | 1,7 | 0,4 | |
| Альбумин | 2,1 | ||
| Каталаза | 1,6 | ||
| Протеинкиназа С | 1,4 |
Наряду с описанной схемой транскрипции у некоторых РНК-овых вирусов известна так называемая обратная транскрипция, при которой матрицей для синтеза ДЕК является РНК и которая осуществляется ферментом, получившим название обратной транскрип-тазы (ревертазы). Здесь реализация генетической информации идет по схеме РНК — ДНК — белок. Как свидетельствуют исследования, обратная транскриптаза найдена как у прокариотов, так и эукариотов. Считают, что ревертаза имеет очень древнее происхождение и существовала еще до разделения организмов на прокарио-ты и эукариоты.
Трансляция является важной составной частью общего метаболизма клетки и ее сущность заключается в переводе генетической информации с мРНК, являющейся первичным продуктом действия генов, в аминокислотную последовательность белков. Трансляция происходит в цитоплазме на рибосомах и является центральным процессом в синтезе белков, в котором помимо рибосом участвуют мРНК, 3-5 молекул рРНК, 40-60 молекул разных тРНК, аминокислоты, около 20 ферментов (аминоацил-тРНК синтетаз), активирующих аминокислоты, растворимые белки, вовлекаемые в инициацию, элонгацию и терминацию полипептидной цепи.
Рибосомы состоят наполовину из белка и наполовину из рРНК (по 3-5 молекул на каждую рибосому). Размеры рибосом выражают в единицах скорости седиментации при центрифугировании (S). У прокариот размеры рибосом составляют 70 S, у эукариот — 80 S. Рибосомы построены из пары субъединиц (большой и малой), которые диссоциируют по завершению трансляции мРНК. У Е. coli большая субъединица (50 S) содержит две молекулы рРНК (5 S и 23 S) и 30 полипептидов, тогда как малая субъединица (30 S) содержит одну молекулу рРНК (16 S) и 19 полипептидов. У эукариот большая субъединица содержит три разных молекулы рРНК (58, 5,8 S и 20 S), тогда как малая субъединица — одну молекулу рРНК (18 S).
Транспортные (адапторные, растворимые) РНК являются малыми (5 S) молекулами длиной в 75—80 нуклеотидов. Их необходимость в трансляции определяется тем, что в отличие от ферментов, узнающих субстрат прямым образом, кодоны мРНК не способны прямо узнавать аминокислоты. Для этого должны существовать специальные адаптеры, узнающие и кодон и аминокислоту. Функцией таких адаптеров и обладает тРНК. Нуклеотиды тРНК построены из остатка фосфорной кислоты, углеводной части (рибозы) и основания. Главными нуклеотидами тРНК являются адениловый, гуаниловый, цитидиловый и уридиловый нуклеотиды. Вместе с тем одна из особенностей структуры тРНК заключается в том, что все они содержат по нескольку необычных, так называемых минорных нуклеотидов, причем последние являются химическими модификациями аденилового, гуанилового, питидилового и уридило-вого нуклеотидов (в основном в виде метилированных пуринов или нуклеотидов, обладающих метилированной рибозой). Некоторые из этих минорных нуклеотидов находятся в одном и том же районе у разных тРНК.
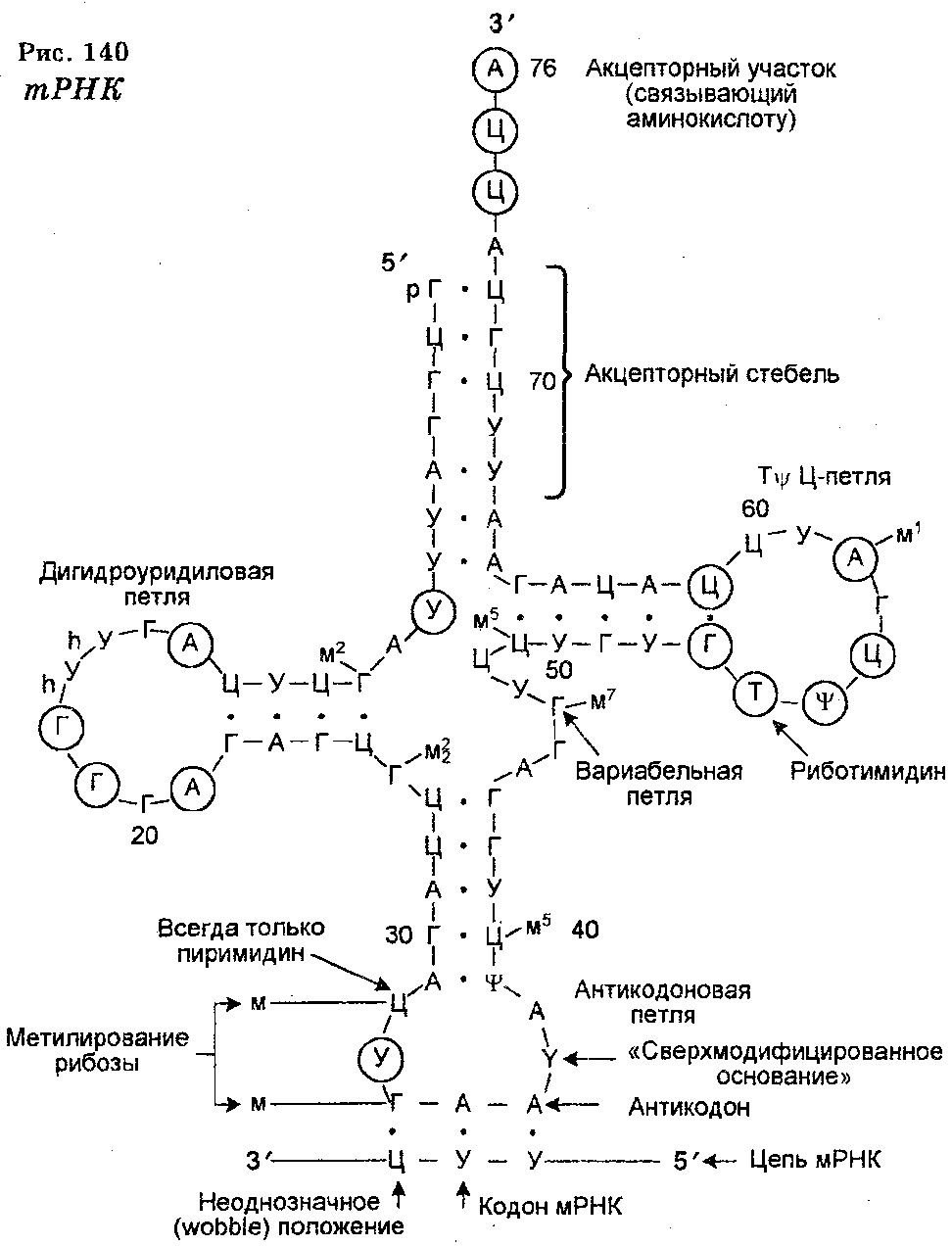
В молекуле тРНК вопреки ее одноцепочечной структуре имеет место комплементарное спаривание оснований, а это ведет к определенной конформации тРНК, заключающейся в том, что четыре ее сегмента формируют свернутую структуру (вторичную), которая имеет форму клеверного листа (рис. 140). В свою очередь эта структура подвергается дальнейшему свертыванию, превращаясь в так называемую многоскладчатую L-образную форму. Важнейшая особенность тРНК заключается в том, что по обоим концам L-образной фигуры сохраняются неспаренные нуклеотиды. Нуклеотиды одного конца фигуры формируют антикодон, а нуклеотиды другого конца (3'-конца) образуют последовательность (ЦЦА), обеспечивающую ковалентную связь с присоединяемой свободной аминокислотой.
Все тРНК характеризуются специфической последовательностью нуклеотидов. Их антикодоны комплементарны кодонам мРНК. Антикодоны располагаются в центре тРНК. Известно 55 антико-донов. Каждая тРНК способна присоединять и переносить только одну аминокислоту, но на каждую аминокислоту имеется 1-4 молекул тРНК.
Первый этап трансляции происходит в цитоплазме и заключается в комбинировании каждой аминокислоты с АТФ (в образовании аденилированной аминокислоты) и специфическим ферментом аминоацил-тРНК-синтетазой (рис. 141). В результате этого устанавливается связь между фосфатом АМФ и карбоксильной группой аминокислоты (-Р-О-С-), которая приводит к образованию комплексов, состоящих из аминокислоты, АМФ и специфического фермента. Пирофосфаты в процессе образования этих комплексов удаляются. Следует заметить, что для каждой аминокислоты существует своя синтетаза, т. е. в клетках имеется 20 разных синтетаз.
Второй этап трансляции осуществляется также в цитоплазме. Поскольку аминоацил-тРНК-синтетазы специфически распознают аминокислоты и их тРНК, то второй этап состоит во взаимодействии образованных комплексов аминокислота — АМФ — специфический фермент (аминоацил-тРНК-синтетаза) со специфическими тРНК (один комплекс — одна тРНК). Поскольку на одном из концов имеется последовательность (конечное основание — аденин, а два предыдущих — цитозин и цитозин), то связывание одной аминокислоты со специфической тРНК происходит путем установления связи между рибозой конечного нуклеотида (адениловой кислотой) и карбоксильной группой аминокислоты (-С—О-С-). Вследствие этого взаимодействия происходит формирование так называемых аминоацил-тРНК, представляющих собой комплексы аминокислоты со специфической тРНК, и освобождение в процессе образования этих комплексов АМФ и фермента (аминоацил-тРНК-синтетазы). Следовательно, аминоацил-тРНК являются прямыми предшественниками полипептидного синтеза на рибосомах.
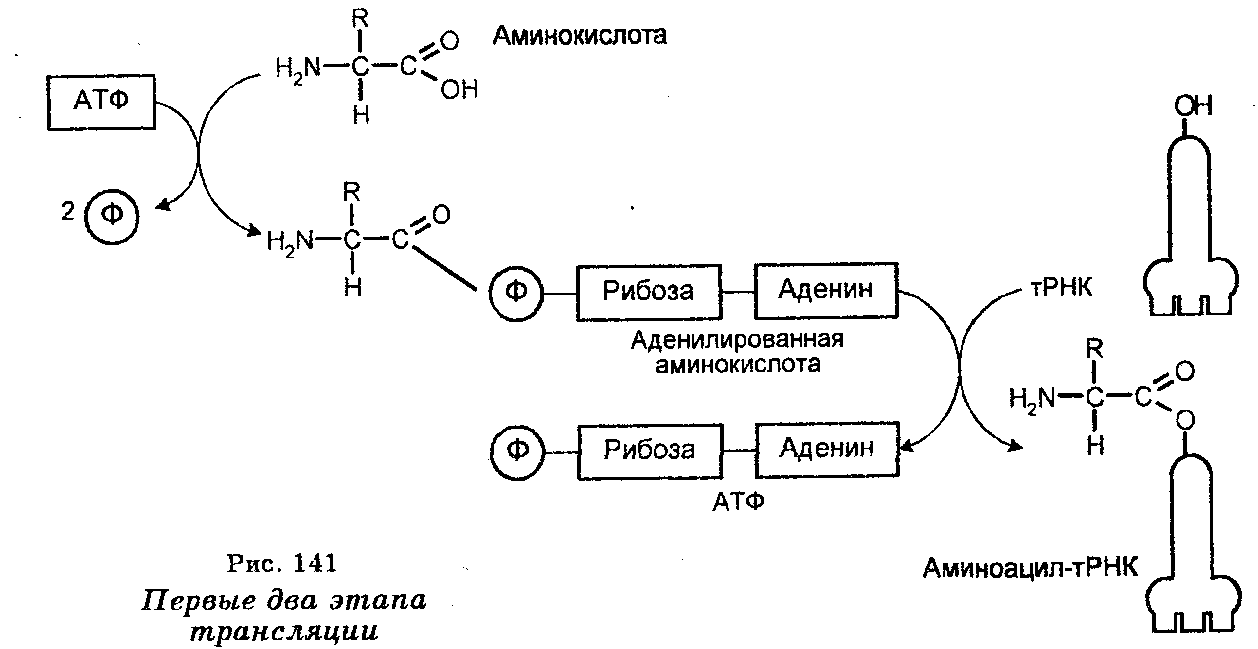
Осуществление этих двух этапов приводит к активации аминокислот. Одни синтетазы активируют 2'-гидроксил конечного основания тРНК, тогда как другие активируют 3'-гидроксил, а некоторые активируют и 2'-и 3'-гидроксилы. Однако эти различия не имеют значения, поскольку после освобождения аминоацильная группа на тРНК мигрирует взад и вперед.
Третий этап трансляции осуществляется на рибосомах и заключается в декодировании мРНК. В нем участвуют как мРНК, так и различные аминоацил-тРНК. Как отмечено выше, мРНК, отошедшая от ДНК в ядре и прошедшая через ядерную мембрану в цитоплазму, прикрепляется к РНК-последовательности меньшей (30 S) субъединицы рибосомы. Выше отмечено также, что последовательность мРНК, которая связывается с последовательностью рРНК рибосомной субъединицы 30 S, получила название рибосомосвязывающего сайта или последовательности Шайно-Дальгарно. Между тем каждая рибосома имеет два сайта, связывающих тРНК. Сайт А или аминоацил-тРНК-связывающий участок (акцепторный сайт), связывает приходящую аминоацил-тРНК, которая несет аминокислоту, предназначенную для добавления в растущую полипептидную цепь рядом с ранее добавленной аминокислотой. Сайт Р, или пептидил-тРНК-связывающий сайт (донорный сайт), связывает пептидил-тРНК, к которой прикреплен растущий полипептид. Специфичность связывания аминоацил-тРНК в этих сайтах обеспечивается кодонами мРНК, которые составляют часть сайтов А и Р. Это связывание происходит благодаря водородным связям, устанавливаемым между определенными основаниями (антикодоном) каждой аминоацил-тРНК и соответствующими основаниями (кодоном) мРНК. Первое и второе основания кодона всегда спариваются с третьим и вторым (соответственно) основаниями антикодона, тогда как третье основание кодона, если оно является урацилом, спаривается с гуанином или гипоксантином антикодона, если же оно является аденином — то с гипоксантином антикодона, но если гуанином — то с урацилом антикодона. Как уже отмечено, в обеспечении взаимодействия мРНК с тРНК участвует рРНК 16 S.
После связывания с мРНК аминоацил-тРНК помещают (включают) аминокислоты вдоль молекулы мРНК в последовательности, 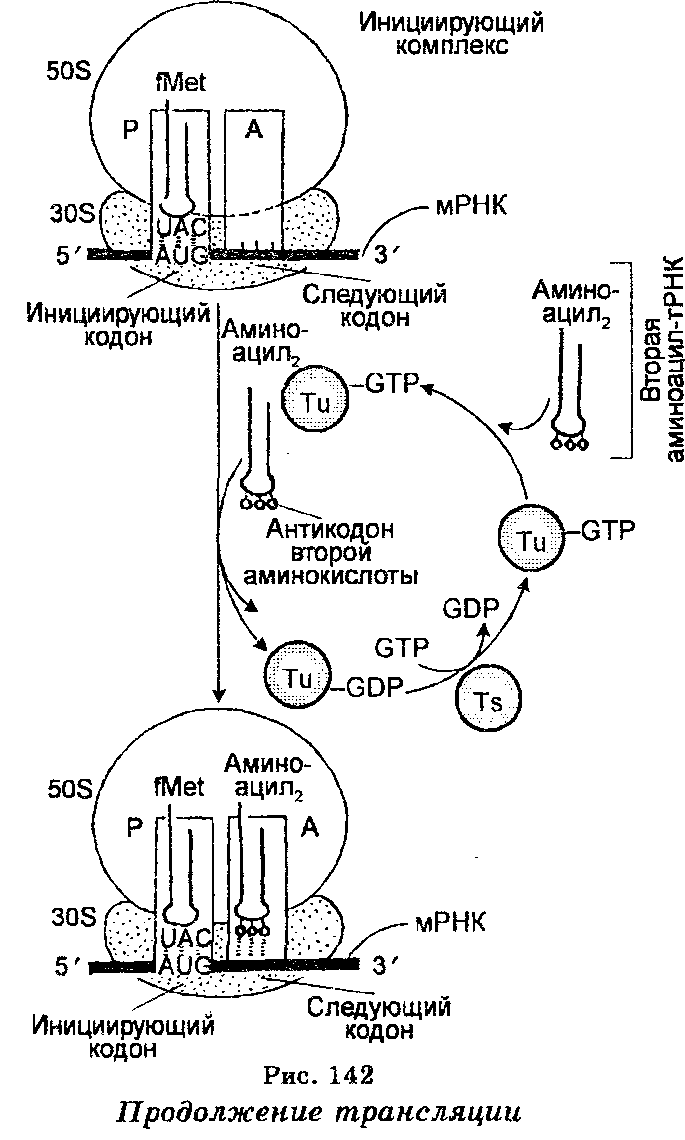 соответствующей последовательности триплетов азотистых оснований в мРНК (рис. 142). Наращивание полипептидной цепи обеспечивается тем, что при синтезе белка рибосомы (полисомы) движутся вдоль цепи мРНК, т. е. рибосомы осуществляют считывание мРНК от одного конца до другого (рис. 143). Эффективность работы рибосом чрезвычайно велика. Например, у бактерий одна рибо-сома за 1 секунду присоединяет к полипептидной цепи свыше 20 аминокислот. Одновременно происходит формирование пептидных связей, обеспечиваемое несколькими ферментами-трансферазами, один из которых катализирует одновременно связывание аминоа-цил-тРНК с рибосомной, происходящее в присутствии ГТФ как кофактора. Каждая пептидная связь образуется ковалентным связыванием атома углерода карбоксильной группы первой аминокислоты с аминогруппой второй аминокислоты. При этом в процессе связывания происходит открепление тРНК первой аминокислоты от углерода карбоксильной группы своей аминокислоты. Каждая вновь добавляемая аминокислота встает на место, следующее за аминокислотой, добавленное ранее. Как видно, полипеп-тидная цепь наращивается с карбоксильного конца, а аминокислоты добавляются последовательно. Трансляция осуществляется в направлении от 5'- к 3'-концу полипептидного тяжа.
соответствующей последовательности триплетов азотистых оснований в мРНК (рис. 142). Наращивание полипептидной цепи обеспечивается тем, что при синтезе белка рибосомы (полисомы) движутся вдоль цепи мРНК, т. е. рибосомы осуществляют считывание мРНК от одного конца до другого (рис. 143). Эффективность работы рибосом чрезвычайно велика. Например, у бактерий одна рибо-сома за 1 секунду присоединяет к полипептидной цепи свыше 20 аминокислот. Одновременно происходит формирование пептидных связей, обеспечиваемое несколькими ферментами-трансферазами, один из которых катализирует одновременно связывание аминоа-цил-тРНК с рибосомной, происходящее в присутствии ГТФ как кофактора. Каждая пептидная связь образуется ковалентным связыванием атома углерода карбоксильной группы первой аминокислоты с аминогруппой второй аминокислоты. При этом в процессе связывания происходит открепление тРНК первой аминокислоты от углерода карбоксильной группы своей аминокислоты. Каждая вновь добавляемая аминокислота встает на место, следующее за аминокислотой, добавленное ранее. Как видно, полипеп-тидная цепь наращивается с карбоксильного конца, а аминокислоты добавляются последовательно. Трансляция осуществляется в направлении от 5'- к 3'-концу полипептидного тяжа.
тРНК характеризуются исключительно высокой специфичностью, что проявляется в их антикодоновых последовательностях, соответствующих кодонам, доступности для распознания нужной аминоацил-тРНК-синтетазой и в точности связывания с сайтами А и Р на рибосомах.
Инициация, элонгация и терминация полипептидного синтеза находятся под генетическим контролем.
Наряду с кодонами, детерминирующими последовательность аминокислот, существуют кодоны, определяющие начало и конец чтения иРНК. В синтезе белка существенная роль принадлежит N-концевой аминокислоте формилметионину и его тРНК. N-формилметионил-тРНК (ОНС×NH×CH×(CH2×CH2× SCH3)CO×О×тРНК) образуется в результате формилирования а-ами-ногруппы метионина NH2×СН(СН2×СН2×SCH3)×СО×ОН в метионил-тРНК. Поскольку формулирование характерно только для метионина и катализируется ферментом трансформилазой, то считают, что формилметионин-тРНК является инициатором синтеза полипепти-да. Это означает, что все полипептиды в процессе синтеза начинаются с метионина. N-формилметионин является N-концевой аминокислотой всех белков.
Инициация полипептидной цепи у кишечной палочки начинается с образования комплекса между мРНК, формилметионин-тРНК и рибосомной единицей 30 8, которое обеспечивается факторами (белками) инициации IF1, IF2 и IF3, а также ГТФ. Этот комплекс вступает в комбинацию с 50 S-рибосомной единицей, в результате чего формилметионин-тРНК становится связанной с пептидиловым сайтом. Энергия для этого обеспечивается гидролизом одной молекулы ГТФ. Кодоны АУГ, ГУА и ГУГ на 5'-конце или рядом с ним направляют включение N-формилметионина в качестве N-концевой аминокислоты белка. Можно сказать, что эти кодоны являются специфическими инициаторами белкового синтеза. Наиболее активным является кодон АУГ.
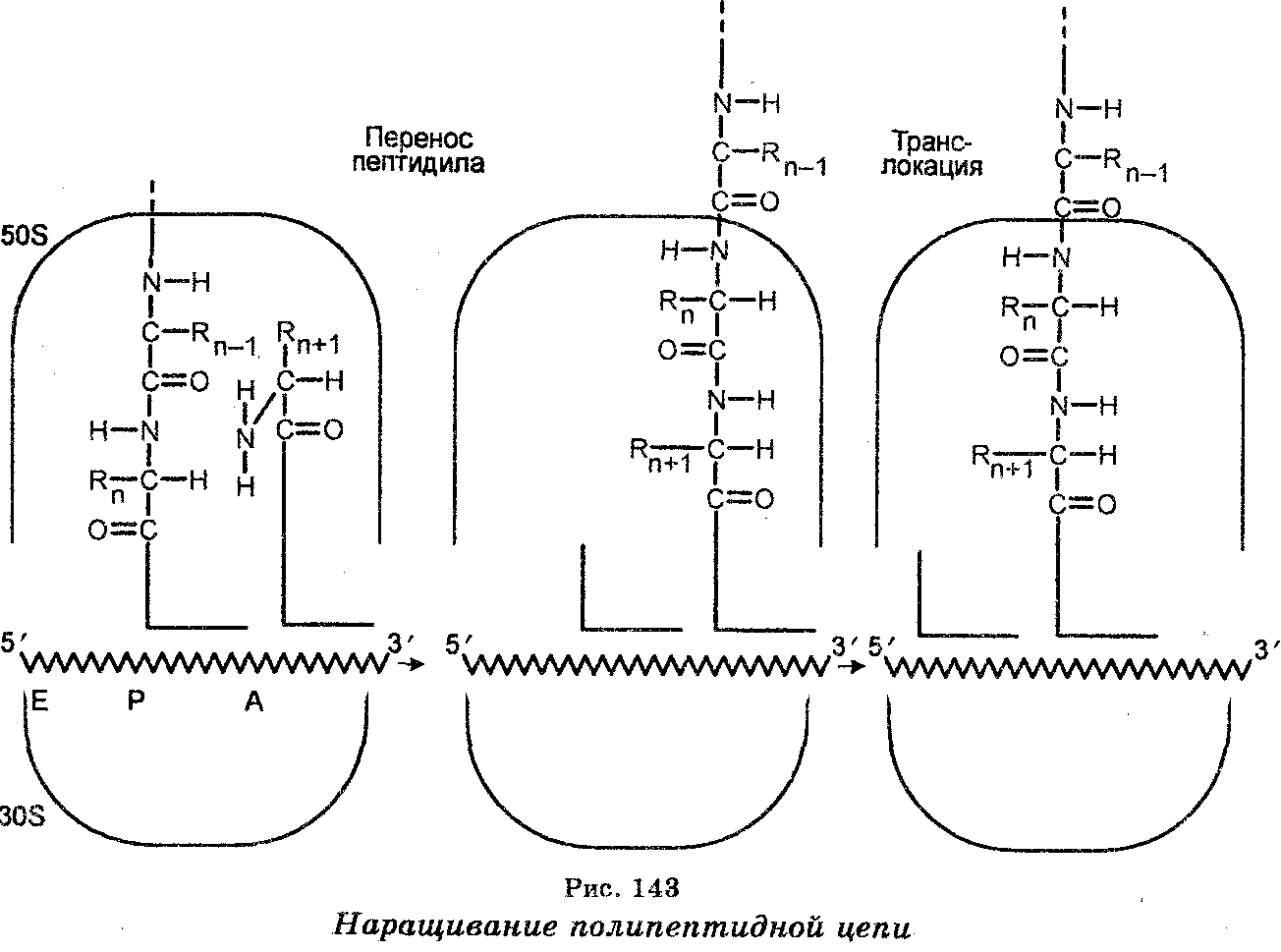
Элонгация (удлинение) полипептидной цепи обеспечивается белковыми факторами элонгации ef-TS и EF-Tu, а также гидролизом одной молекулы ГТФ, а движение молекулы мРНК с одного сайта рибосомы на другой обеспечивается фактором элонгации EF-G и гидролизом одной молекулы ГТФ. Каждый раз мРНК движется на три нуклеотида. У бактерий частота элонгации составляет 16 аминокислот в секунду. Это означает, что рибосомы двигаются вдоль мРНК со скоростью 48 нуклеотидов в секунду.
Терминация (окончание) синтеза детерминируется стоп-кодо-нами УАГ, УАА и У ГА. Когда один из этих кодонов подойдет к А-сайту рибосомы, то полипептид, тРНК в Р-сайте и мРНК освобождаются, а рибосомные субъединицы диссоциируют. Окончание синтеза белка связано с активностью белковых факторов освобождения — RF-1 и RF-2. Диссоциировав, рибосомные субъединицы начинают трансляцию другой молекулы мРНК. Большинство мРНК симультанно транслируется несколькими рибосомами (полисомами). Например, цепь гемоглобина из 150 аминокислот синтезируется на пентарибосомном комплексе. У прокариот синтез и трансляция мРНК происходят в направлении от 5'-конца к 3'-концу. Далее, у них нет ядерной мембраны. Поэтому трансляция мРНК начинается еще до завершения ее синтеза. Напротив, у эукариот транскрипция и трансляция разделены во времени, поскольку требуется время для перехода мРНК из ядра через ядерную мембрану в цитоплазму.
Синтез белков является исключительно точным механизмом. Обобщенные результаты исследований частоты ошибок в белковом синтезе показывают, что одна ошибка, т. е- одно включение «неправильной» аминокислоты, происходит лишь на каждые 10 000 включенных аминокислот. Точность механизма белкового синтеза обеспечивается точностью связывания аминокислот со своими тРНК и точностью спаривания кодонов мРНК с антикодонами тРНК.
Дата добавления: 2015-12-29; просмотров: 2077;
