Метод Фаянса-Ходакова
Метод заснований на прямому титруванні галогенідів стандартним розчином AgNO3 у присутності адсорбційних індикаторів – флуоресцеїну, еозину та ін.
Аніони цих індикаторів адсорбуються на поверхні утворюваних осадів арґентум галогенідів поблизу точки еквівалентності, що призводить до зміни забарвлення суміші, яку титрують, і дозволяє фіксувати кінцеву точку титрування.
Титрування хлоридів у присутності флуоресцеїну проводять у нейтральному середовищі. При низькому значенні pH флуоресцеїн, будучи кислотою HInd, слабко дисоціює, концентрація Ind– незначна, а вони і обумовлюють забарвлення. У лужному середовищі осаджується Ag2O.
При застосуванні індикатора еозину титрують у слабкокислому середовищі.
Метод Фольгарда
Роданометричний метод Фольгарда титриметричного аналізу заснований на застосуванні як осадника титрованого розчину, що містить йони тіоціанату (SCN–).
Стандартними розчинами є розчини амоній тіоціанату або калій тіоціанату, с=0,05моль/дм3 чи с=0,1моль/дм3, а також розчини аргентум нітрату з с=0,05моль/дм3; с=0,1моль/дм3.
Методом прямого титрування визначають Ag+ та SCN– у присутності індикатора – солей Fe(ІІІ) у вигляді залізоамонійного галуну NH4[Fe(SO4)2]·12H2O.
Визначення солей Аргентуму засновано на реакції:
Ag+ + SCN– " AgSCN$;
ДР(AgSCN) = 1,1·10–12.
Після повного осадження йонів Ag+ надлишкова крапля титранту реагує з йонами Fe3+ з утворенням водорозчинних комплексних йонів [Fe(SCN)]2+, [Fe(SCN)2]+, [Fe(SCN)6]3–, а також [Fe(SCN)3].
Непрямий метод Фольгарда передбачає пряме титрування досліджуваного йона розчином аргентум нітрату, але до досліджуваного розчину галогеніду, підкисненого нітратною кислотою, додають індикатор – розчин залізоамонійного галуну та невелику кількість (0,1см3) розчину NH4SCN (с=0,1моль/дм3) та титрують до зникнення рожевого забарвлення [Fe(SCN)3], що утворюється при взаємодії Fe3+ з SCN–.
Спочатку Ag+ взаємодіє з галогенід-іонами:
Ag+ + Hal– " AgHal$.
Надлишкова крапля реагенту AgNO3 взаємодіє із забарвленим [Fe(SCN)3], внаслідок чого розчин над осадом знебарвлюється:
[Fe(SCN)3] + 3Ag+ " 3AgSCN$ + Fe3+.
У методі зворотного титрування використовується два робочих розчини – розчин AgNO3 та розчин NH4SCN або KSCN.
До розчину галогеніду, що аналізується, додають у надлишку певний об’єм стандартного розчину AgNO3:
Ag+ + Hal– " AgHal$.
Надлишок Ag+ відтитровують стандартним розчином NH4SCN у присутності індикатора – розчину залізоамонійного галуну:
Ag+ + SCN– " AgSCN$;
Fe3+ + 3SCN– " [Fe(SCN)3]$.
У кінцевій точці титрування розчин над осадом забарвлюється в червоний колір.
Метод Фольгарда має ряд переваг у порівнянні з методами Мора і Фаянса. Його застовують для визначення хлоридів, бромідів, йодидів, роданідів і Ag+–іонів. Метод можна застосовувати для титрування кислих розчинів, бо AgSCN нерозчинний у кислотах.
При титруванні за цим методом присутні у досліджуваному розчині йони Ba2+, Pb2+ та ін. у більшості випадків не заважають визначенню.
Заважають йони Hg2+, які утворюють осад з SCN–-іонами, а також йони F–, які утворюють комплекс із солями феруму(ІІІ):
Fe3+ + 6F– " [FeF6]3–.
Осаджений аргентум роданід адсорбує на своїй поверхні йони Ag+, що збільшує помилку визначення, тому титрування потрібно проводити при інтенсивному перемішуванні.
При визначенні йодид-іонів можливе їх окиснення до вільного йоду йонами Fe3+:
2Fe3+ + 2I– " I2 + 2Fe2+,
тому індикатор треба додавати наприкінці титрування.
При визначенні хлорид-іонів можлива обмінна реакція:
AgCl$ + SCN– " AgSCN + Cl–,
і для запобігання контакту частинок AgCl з тіоцианат-іонами додають у розчин 1-2см3 CCl4, CHCl3.
Меркурометрія
Меркурометричний метод аналізу заснований на реакціях осадження галогенід–іонів йонами 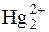 . Утворювані меркурій(І) галогеніди є практично нерозчинні:
. Утворювані меркурій(І) галогеніди є практично нерозчинні:
ДР(Hg2Cl2)=1,3·10–18; ДР(Hg2I2)=4,5·10–29; ДР(Hg2Br2)=5,8·10–23.
Титрантом у цьому методі є розчин Hg2(NO3)2 в розведеній нітратній кислоті. Цей стандартний розчин є вторинним стандартом, оскільки приготувати титрований робочий розчин Hg2(NO3)2 з наважки неможливо, так як меркурій(І) нітрат є нестійкий і містить домішки Hg2+-іонів. У зв’язку з цим, перед стандартизацією титрант витримують над металевою ртуттю не менш доби, що сприяє відновленню йонів Hg2+:
Hg2+ + Hg " 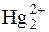 .
.
У меркурометрії використовують індикатори – ферум (ІІІ) тіоціанат, дифенілкарбазон.
Застосування індикатора Fe(SCN)3 засноване на тому, що після осадження галогенід-іонів у розчині з’являється надлишок йонів 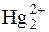 , які реагують з роданід-іонами, внаслідок чого червоне забарвлення розчину зникає.
, які реагують з роданід-іонами, внаслідок чого червоне забарвлення розчину зникає.
3 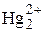 +2 [Fe(SCN)3] " 3Hg2(SCN)2 + 2Fe3+.
+2 [Fe(SCN)3] " 3Hg2(SCN)2 + 2Fe3+.
Дія індикатора дифенілкарбазону заснована на тому, що після повного осадження галогенід–іонів надлишкова крапля титранту утворює з дифенілкарбазоном або осад синього кольору в нейтральному чи слабкокислому середовищі, або розчин синього кольору в середовищі нітратної кислоти з с(HNO3)=6,0моль/дм3:

Дифенілкарбазон має переваги над ферум(ІІІ) роданідом, бо створюється можливість титрування в сильнокислому середовищі, а також у забарвлених чи каламутних розчинах. З іншого боку, з дифенілкарбазоном можливе зворотне титрування.
Оскільки меркурій(І) галогеніди менш розчинні, ніж аргентум галогеніди, тому при титруванні розчинів галогенідів розчином меркурій (І) нітрату спостерігається різкий стрибок титрування поблизу точки еквівалентності, що значно підвищує точність визначення.
Меркурометричному визначенню хлорид–іонів не заважають деякі окисники чи відновники ( 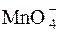 ;
; 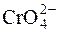 ; H2O2;
; H2O2;  ;
; 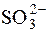 ;
; 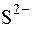 ).
).
Дата добавления: 2015-12-26; просмотров: 2836;
