Природа химической связи
Химическая связь – взаимодействие атомов, обуславливающее их соединение в молекулы и кристаллы.
В 1807 г. Дэви предположил, что молекулы образуются благодаря электрическому притяжению разноименно заряженных атомов. Берцелиус развил эту идею и в 1812-1818 гг. создал электрохимическую теорию химической связи. Согласно теории любой атом обладает как положительным, так и отрицательным полюсами. Атомы с преобладанием положительного полюса притягиваются к атомам с преобладанием отрицательного. Получившаяся молекула может также обладать избыточным зарядом, положительным или отрицательным, и притягиваться к другой молекуле. Например:
Са+ + О– → СаО+ ; СаО+ + CO2– → CaCO3 .
Однако теория Дэви-Берцелиуса не могла объяснить существование ряда молекул, например, H2, Cl2, O2, образованных одинаковыми атомами.
В 1860-е годы Бутлеров разработал теорию химического строения, в которой выдвинул следующее положение:
Атомы в молекулах соединены друг с другом в определенной последовательности в соответствии с их валентностью, и от этой последовательности зависят свойства вещества.
Валентность – это свойство атома соединяться с некоторым числом других атомов. Бутлеров предложил изображать внутреннюю структуру молекул в виде формул вида:
Н – Cl ; H – O – Cl ;
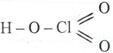 , где черточка обозначает химическую связь между атомами.
, где черточка обозначает химическую связь между атомами.
После открытия электрона и строения атома валентность стали связывать с числом электронов на периферии атома. В 1916 году Льюис предположил, что ковалентная химическая связь возникает путем образования электронной пары, общей двум атомам, и поэтому молекула является более устойчивой системой, чем отдельные атомы.
H • + H • → H : Н (образование молекулы Н2).
В том же году Кóссель высказал подобную идею об образовании ионной связи. Однако, в этом случае, один из атомов полностью отдает валентный электрон другому атому. Устойчивость соединения обеспечивается электрическим притяжением образовавшихся ионов. Na • + • 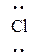 : → Na+ Cl– (образование соединения NaCl).
: → Na+ Cl– (образование соединения NaCl).
Если ввести понятие энергии химической связи, как энергии, необходимой для ее разрыва, то закон сохранения энергии приводит к выводу о том, что устойчивая молекула может образоваться только при уменьшении потенциальной энергии взаимодействия электронов и ядер исходных атомов. В рамках квантовой механики это взаимодействие микрочастиц в молекуле в принципе может быть описано теоретически путем решения уравнения Шрёдингера для системы электронов и ядер при наименьшем значении потенциальной энергии.
Однако, для многоэлектронных систем точное решение получить не удается ввиду математических трудностей, и поэтому в практических расчетах используют приближенные решения, которые согласуются с экспериментальными данными об энергиях связи и межъядерных расстояниях в молекулах.
Впервые такой расчет был проведен в 1927 г. для молекулы Н2 (Гейтлер, Лондон).
Взаимодействие электрона с ядром в каждом атоме Н они считали основным взаимодействием, а взаимодействия между электронами и ядрами разных атомов Н учли в виде малых поправок к основному взаимодействию. В результате решения уравнения Шрёдингера удалось получить зависимость энергии (W) системы от расстояния между ядрами r. Оказалось, что существует определенное расстояние r0, соответствующее минимуму W.
В пространстве между ядрами достигается также наибольшая плотность отрицательного заряда, получающаяся при перекрытии двух электронных облаков. Устойчивость молекулы Н2 обеспечивается притяжением ядер атомов к области наибольшей плотности электронного заряда в межъядерном пространстве.
В дальнейшем Пóлинг распространил метод Гейтлера-Лондона на другие молекулы с ковалентной связью, а потом различные методы квантовой механики были применены также к другим типам химической связи. Параллельно проводились экспериментальные исследования молекулярных структур.
Таким образом, начиная с 1930-х гг. можно говорить о появлении квантовой химии, как раздела теоретической химии, рассматривающей химические явления с точки зрения квантовых представлений о веществе. В настоящее время считается, что:
1) любая химическая связь есть вид электромагнитного взаимодействия электронов и ядер атомов в молекулах;
2) ее образование сопровождается перестройкой электронной структуры атомов;
3) положение электронов относительно ядер определяет тип химической связи;
4) современная теория химической связи должна использовать квантовую механику.
Дата добавления: 2015-12-26; просмотров: 2260;
