Современная рациональная классификация аминокислот
в соответствии с ней все аминокислоты делятся на 4 группы.
I – Неполярные гидрофобные аминокислоты – их 8.
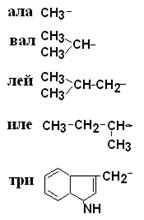
| Аланин Валин Лейцин Изолейцин Триптофан |
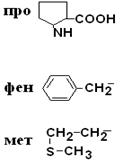
| Пролин Фенилаланин Метионин |
II –Полярные гидрофильные незаряженные аминокислоты – их 7.
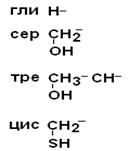
| Глицин Серин Треонин Цистеин |
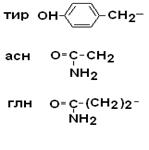
| Тирозин Аспарагин Глутамин |
III – Отрицательно заряженные кислые аминокислоты
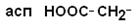
| Аспарагиновая кислота |
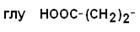
| Глутаминовая кислота |
IV Положительно заряженные основные аминокислоты
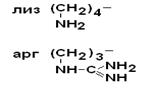
| Лизин Аргинин |
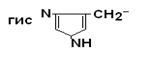
| Гистидин |
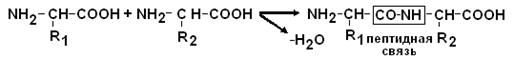
Образование пептидных связей.
a–СООН группа одной аминокислоты может реагировать с a–NH2 группой другой аминокислоты с образованием пептидных связей.
|
Пептидные цепи белков – это линейные полимеры a–АК, соединенных пептидной связью.
Мономеры аминокислот, входящих в состав полипептидов, называются аминокислотными остатками, цепь повторяющихся групп –NH–CH–CO– называется пептидным остовом. Аминокислотный остаток, имеющий свободную NH2–группу называется N–концевым, а имеющий свободным α–карбоксигруппу – С–концевым.
Пептиды пишутся и читаются с N–конца.
Пептидная связь, образуемая аминогруппой пролина, отличается от других пептидных связей: у атома азота пептидной группы отсутствует водород, вместо него имеется связь с R.
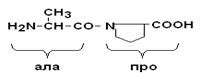
Пептидные связи очень прочные, для их неферментного гидролиза in vitroтребуются жесткие условия: высокие t° и r, кислая среда, длительное время. In vivo, где нет таких условий, пептидные связи могут разрываться с помощью протеолитических ферментов (E), называемых протеазами или пептидгидролазами.
Полипептидная теория строения белков была предложена в 1902 г. Э.Фишером, в ходе дальнейшего развития биохимии эта теория была экспериментально доказана.
Экспериментальные доказательства полипептидного
строения белков
1. Титруются только концевые COOH– и NH2– группы.
2. При гидролизе белков образуется стехеометрическое количество титруемых COOH– и NH2–групп (происходит распад определенного числа пептидных связей).
3. Под действием протеолитических ферментов (протеаз) белки расщепляются на строго определенные фрагменты с концевыми аминокислотами, соответствующими избирательному действию протеаз.
4. Биуретовую реакцию (раствор сульфата меди CuSO4 в щелочной среде – сине-фиолетовое окрашивание) дают и биурет (NH2–CO–NH–CO–NH2), содержащий пептидную связь и белки.
5. Проведенный рентгеноструктурный анализ (разрешительная способность 0,15-0,2 нм) показывает на рентгенограмме пептидную связь.
6. Самое убедительное доказательство – это синтез химическими методами белков с уже расшифрованной структурой. Синтезированные белки обладают физико-химическими свойствами и биологической активностью, аналогичными природным белкам .
ЛЕКЦИЯ 2
Дата добавления: 2015-12-22; просмотров: 929;
