Кинетика реакций горения
Уравнения реакций горения отдельных газов дают представления лишь о начальной и конечной стадиях процесса горения, не раскрывая последовательности его протекания. В действительности в процессе горения идет непрерывное образование промежуточных продуктов горения, реагирующих между собой, т.е. процесс горения складывается из элементарных реакций.
Согласно кинетической теории газов, элементарная реакция горения газа может произойти при столкновении молекул, сопровождающемся ослаблением и разрушением внутримолекулярных связей. Следовательно, скорость любой реакции будет зависеть от частоты столкновений молекул, которая в свою очередь зависит от концентрации реагирующих веществ, их температуры и давления.
 В процессе обратимой реакции mА + nВ pЕ + qД. В первой прямой ее стадии концентрация исходных веществ А и В уменьшается, а концентрация конечных продуктов Е и Д увеличивается. Коэффициенты m, n, p и q характеризуют стехиометрические соотношения компонентов реакции. Изменение концентрации С исходных веществ по времени τ определяет скорость прямой реакции w.
В процессе обратимой реакции mА + nВ pЕ + qД. В первой прямой ее стадии концентрация исходных веществ А и В уменьшается, а концентрация конечных продуктов Е и Д увеличивается. Коэффициенты m, n, p и q характеризуют стехиометрические соотношения компонентов реакции. Изменение концентрации С исходных веществ по времени τ определяет скорость прямой реакции w.
w = -dC/dτ. (10.18)
Так как компоненты реакции взаимосвязаны стехиометрическими соотношениями, то показателем скорости реакции может служить изменение концентрации одного из компонентов. Знак минус перед выражением для скорости реакции означает, что концентрация исходного вещества уменьшается и за счет этого уменьшается скорость прямой реакции. Однако в принципе рассматриваемые реакции обратимы, т.е. возможно протекание обратной реакции с образованием исходных веществ из конечных продуктов.
По мере уменьшения концентрации исходных веществ и увеличения концентрации конечных продуктов скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается. Когда обе скорости становятся равными, наступает состояние так называемого химического равновесия, которое является равновесием динамическим, т.е. устанавливающимся в условиях фактически продолжающегося процесса в реагирующей системе.
Далее будет показано, что прямая реакция протекает с выделением тепла, т.е. является экзотермической, а обратная - с поглощением тепла, т.е. является эндотермической. Из сказанного следует, что при сжигании газового топлива в теплотехнических установках необходимо течение обратных реакций предупредить или ограничить до минимума. Это достигается интенсивным отводом тепла, выделяющегося при прямых реакциях, своевременным удалением из зоны горения продуктов сгорания и непрерывной подачей топлива в зону горения для поддержания необходимой концентрации исходных компонентов реакции.
Из многочисленных столкновений молекул при их тепловом движении элементарные реакции происходят лишь при столкновении активных молекул, обладающих в момент соударения энергией, достаточной для разрушения внутримолекулярных связей, существовавших до столкновения. Минимальная величина этой энергии, определенная для каждой реакции, называется энергией активации.
Для распространенных горючих газов она составляет 70000-140000 ккал/кмоль. В результате разрушения существовавших молекулярных связей образуется новые. Это сопровождается выделением тепловой энергии. Если выделяющаяся энергия больше затраченной энергии активации, то реакция имеет положительный тепловой эффект и наоборот.
Понятие об энергии активации является ключом для понимания теории цепных реакций, разработанной акад. Н.Н. Семеновым и его последователями, объясняющей почти мгновенный взрывной характер реакций горения газового топлива. Согласно этой теории в процессе начавшегося горения каждая активная молекула, обладающая энергией активации, быстро порождает ряд новых активных центров, которые последующими соединениями образуют разветвленные цепные реакции, быстро ускоряющие протекание реакций.
 Например, результирующая реакция сгорания водорода выражается уравнением 2H2 + О2 = 2Н2О. Действительный процесс горения следующий. Молекула водорода Н2, сталкиваясь с какой-либо активной молекулой М, распадается на два атома водорода: Н2 + М Н + Н + М. Атомарный водород Н, являясь активным центром, разрушает молекулу кислорода О2 и образует два активных центра: радикал ОН и атом кислорода О. Эти центры реагируют с молекулами Н2 и образуют молекулу воды Н2О и три активных центра: два атома водорода Н и один радикал ОН. Образовавшиеся атомы водорода становятся возбудителями новых ответвлений цепи реакций, а радикал ОН, реагируя с новой молекулой водорода Н2, образует молекулу воды Н2О и атом водорода Н, и т.д.
Например, результирующая реакция сгорания водорода выражается уравнением 2H2 + О2 = 2Н2О. Действительный процесс горения следующий. Молекула водорода Н2, сталкиваясь с какой-либо активной молекулой М, распадается на два атома водорода: Н2 + М Н + Н + М. Атомарный водород Н, являясь активным центром, разрушает молекулу кислорода О2 и образует два активных центра: радикал ОН и атом кислорода О. Эти центры реагируют с молекулами Н2 и образуют молекулу воды Н2О и три активных центра: два атома водорода Н и один радикал ОН. Образовавшиеся атомы водорода становятся возбудителями новых ответвлений цепи реакций, а радикал ОН, реагируя с новой молекулой водорода Н2, образует молекулу воды Н2О и атом водорода Н, и т.д.
Образующиеся в рассмотренных превращениях свободные атомы водорода и кислорода, а также гидроксильный радикал ОН с нестойкой молекулярной связью реагируют в дальнейших реакциях без затраты большой энергии активации, поэтому эти реакции идут гораздо быстрее обычных молекулярных реакций. Общий итог единичного цикла имеет следующую схему (рис. 8.1):  Н + О2 + 3Н2 3Н + 2Н2О
Н + О2 + 3Н2 3Н + 2Н2О
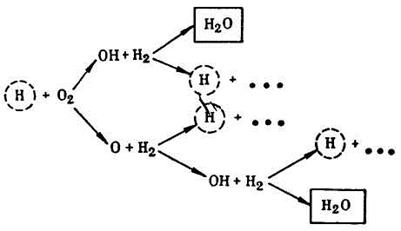
Рис. 10.1. Реакция сгорания водорода
За счет прогрессирующего увеличения активных, центров и большой скорости реакций общая цепная реакция горения приобретает лавинный характер, почти мгновенно распространяясь по всему объему смеси.
При определенных условиях аналогично протекает цепная реакция горения углеводородов, сопровождающаяся образованием нестойких промежуточных соединений - гидроксильного радикала ОН, метилового спирта СН3ОН и формальдегида НСНО, а также твердых частиц углерода, образующихся в результате термического разложения углеводородов и придающих пламени светимость.
Дата добавления: 2015-12-22; просмотров: 2801;
