Особенности сжигания газообразного топлива
Горением называют химическую цепную реакцию, протекающую сравнительно быстро во времени и сопровождающуюся интенсивным выделением теплоты, резко повышающим температуру вступившей в реакцию смеси.
При обычной температуре процессы соединения горючих газов с кислородом воздуха (процессы окисления) протекают очень медленно, почти незаметно. Происходит это потому, что выделяющееся при таком окислении значительное количество теплоты компенсируется теплопотерями в окружающем пространстве, вследствие чего не наблюдается ни повышения температуры, ни ускорения процесса окисления. При повышении температуры горючей смеси скорость реакции окисления будет постепенно возрастать, и при температуре, называемой «температурой воспламенения», процесс медленного окисления переходит в самопроизвольный процесс горения, не требующий больше притока извне. С этого момента, выделяющаяся при горении теплота не только компенсирует потери тепла в окружающее пространство, но и обеспечивает подогрев соседних частиц газовоздушной смеси до температуры воспламенения.
Рассмотрим количественные соотношения между исходными, реагирующими веществами и конечными продуктами.
Реакции, в которых отношение количеств исходных веществ строго соответствует условию получения конечных продуктов, называют стехиометрическими.
Для наиболее часто встречающихся, на практике реакций горения горючих газов с кислородом можно написать следующие уравнения (без учета теплоты реакции):
для водорода Н2 + 1/2 О2 = Н2О;. (9.1)
для окиси углерода: СО2 + 1/2 О2 = СО2; (9.2)
 для углеводородов: CmHn + (m + n/4) O2 = mCO2 + n/2H2O. (9.3)
для углеводородов: CmHn + (m + n/4) O2 = mCO2 + n/2H2O. (9.3)
Из уравнения (9.3) видно, что для полного окисления 1 м3 углеводородного газа до углекислого газа и воды необходимо (m + n/4) м3 кислорода, где m и n - количество атомов углерода и водорода в молекуле окисляемого газа.
Запишем уравнения реакции горения углеводородов:
метан СН4 + 2О2 = СО2 + 2Н2О;
этан С2Н6 + 3,5О2 = 2СО2 + 3Н2О;
пропан С3Н8 + 5О2 = 3СО2 + 4Н2О;
бутан С4Н10 + 6,5О2 = 4СО2 + 5Н2О.
Кислород для окисления подается обычно как составная часть воздуха, в котором его содержится 20,9%. Без учета небольшого количества примесей можно считать, что остальная часть воздуха (79,1%) состоит из азота. Обычно эти значения, округляют и считают, что на 1 м3 кислорода приходится 100/21 = = 4,76 м3 воздуха и 79/21 = 3,76 м3 азота. Тогда для реакции горения с воздухом можно написать:
H2 + 1/2(O2 + 3,76N2) = H2O + 1,88N2; (9.4)
CO + 1/2(O2 + 3,76N2) = CO2 + 1,88N2; (9.5)
CmHn + (m + n/4)(O2 + 3,76N2) = mCO2 + n/2H2O + 3,76(m + n/4)N2. (9.6)
Для природных газов, состоящих в основном из предельных углеводородов метанового ряда, стехиометрическое уравнение для реакции полного сгорания можно представить в следующем виде:
CmH2m+2 + (3m + 1)/2∙(O2 + 3,76N2) = mCO2 + (m+1)H2O + 3,76(3m+1)/2∙N2, (9.7)
а для метана, первого углерода этого ряда:
СН4 + 2(О2 + 3,76N2) = СO2 + 2Н2О + 7,52N2. (9.8)
Таким образом, как это следует из определения, при стехиометрическом сжигании метана объем реагирующей смеси [(1+ 2∙4,76) м3] равен объему продуктов сгорания [(1 + 2 + 7,52) м3].
Из уравнений (9.4)-(9.8) определяют наименьшее количество воздуха, необходимое для полного сгорания 1 м3 газа, или, так называемое теоретическое количество воздуха V0.
Для всех углеводородов
V0 = 4,76(m + n/4); (9.9)
для предельных углеводородов метанового ряда
V0 = 4,76(3m + 1)/2; (9.10)
Следовательно, для метана V0 = 4,76∙2 = 9,52 м3/м3.
Стехиометрические уравнения позволяют определить объемы отдельных составляющих в продуктах сгорания. При полном сгорании 1 м3 горючего газа, состоящего из различных углеводородов, в соответствии с уравнением (9.6), объем углекислого газа
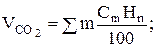 (9.11)
(9.11)
объем паров воды  (9.12)
(9.12)
объем азота 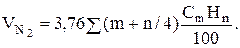 (9.13)
(9.13)
Суммарный объем продуктов сгорания
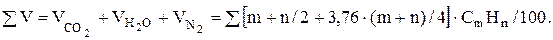 (9.14)
(9.14)
Обычно горение происходит при количестве воздуха, превышающем теоретическое, так как трудно добиться идеального смешения воздуха с топливом. Отношение действительного количества подаваемого воздуха Vд к теоретически необходимому V0 называют коэффициентом избытка воздуха α, т.е.
α = Vд / V0, м3/м3.
Необходимость иметь избыток воздуха определяется тем, что на практике крайне трудно бывает обеспечить равномерное перемешивание газа с воздухом. При теоретическом расходе воздуха в отдельных зонах кислорода будет недоставать, что приведет к химическому недожигу, т.е. к неполному сгоранию газа. Коэффициент избытка воздуха в зависимости от качества смешения газа и воздуха всегда больше единицы и обычно принимается в пределах 1,05-1,2. Исключение составляют отдельные процессы обработки металлов, в которых необходима восстановительная среда.
Газовоздушные смеси при величине α = 1,0 (т.е. при отсутствии избытка воздуха) называются стехиометрическими.
Дата добавления: 2015-12-22; просмотров: 1825;
