РН буферных растворов.
Для буферной системы I типа НА/A- концентрацию ионов Н+ в растворе легко вычислить, исходя из константы диссоциации слабой кислоты (для простоты изложения вместо активностей ионов в выражении для 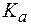 будем использовать их концентрации):
будем использовать их концентрации):
НA ⇄ A- + H+;
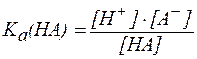 , ,
|
отсюда:
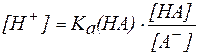 . .
|
В присутствии второго компонента буферного раствора – сильного электролита – равновесие диссоциации слабой кислоты НA, согласно принципу Ле Шателье, смещено влево. Поэтому можно считать, что концентрация недиссоциированных молекул НA практически равна концентрации кислоты в буферном растворе, а концентрация ионов A- равна концентрации соли.
В таком случае можно записать:
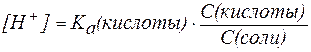 , ,
| (3) |
где С(кислоты) и С(соли) – молярные концентрации кислоты и соли.
Если равенство (3) прологарифмировать (взять отрицательный десятичный логарифм левой и правой частей уравнения), то получим:
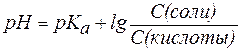 . .
| (4) |
Так, рН фосфатной буферной системы состава NaH2PO4/Na2HPO4 можно рассчитать по уравнению:
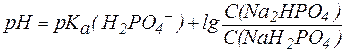 , ,
|
где 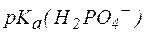 – показатель константы диссоциации фосфорной кислоты по второй ступени.
– показатель константы диссоциации фосфорной кислоты по второй ступени.
В случаях, когда требуется получить буферный раствор с задан-ным значением pH, используют уравнение:
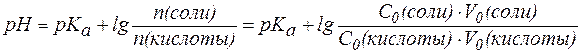 , ,
| (5) |
где индексом «0» обозначены характеристики исходных растворов кислоты и соли, смешиванием которых получают требуемую буферную смесь.
Для буферной системы II типа В/ВН+, например аммонийной, гидроксидный и водородный показатели вычисляют по уравнениям:
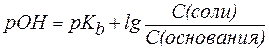 , ,
| (6) |
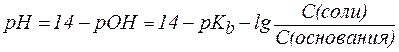 , ,
| (6¢) |
где 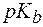 – показатель константы диссоциации основания.
– показатель константы диссоциации основания.
В общем виде уравнение для расчета pH буферных систем выглядит следующим образом:
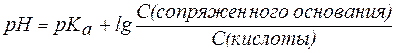 , ,
| (7) |
и называется уравнениемГендерсона-Гассельбаха.
Из уравнения Гендерсона-Гассельбаха следует, что:
1. Величина рН буферных растворов зависит от константы диссоциации кислоты или основания и от соотношения количеств компонентов, но практически не зависит от разбавления или концент-рирования растворов. Действительно, в этих процессах концентрации компонентов буферного раствора изменяются пропорционально, поэтому их соотношение, которое определяет значение рН буферного раствора, остается неизменным.
Если концентрации компонентов буферных растворов превы-шают 0,1 моль/л, то в расчетах необходимо учитывать коэффициенты активности ионов системы.
2. Показатель константы диссоциации слабого электролита опре-деляет область буферного действия раствора, т.е. тот интервал значе-ний водородного показателя, в котором сохраняются буферные свой-ства системы. Поскольку буферное действие продолжается, пока не израсходовано 90% компонента (т.е. его концентрация не уменьши-лась на порядок), то область (зона) буферного действия отличается от 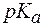 на 1 единицу:
на 1 единицу:
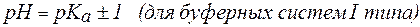 ;
;
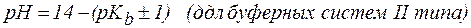 .
.
Амфолиты могут иметь несколько зон буферного действия, каждая из которых отвечает соответствующей константе 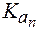 :
:
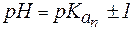 .
.
Таким образом, максимально допустимое соотношение компонентов раствора, при котором он проявляет буферное действие, составляет 10:1.
Пример 1. Можно ли приготовить ацетатный буфер с рН = 6,5, если 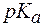 уксусной кислоты равен 4,74?
уксусной кислоты равен 4,74?
Решение.
Поскольку зона буферного действия определяется как 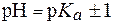 , для ацетатного буфера она находится в интервале значений рН от 3,74 до 5,74. Значение рН = 6,5 лежит за пределами зоны действия ацетатного буфера, поэтому на основе ацетатной буферной системы такой буфер приготовить нельзя.
, для ацетатного буфера она находится в интервале значений рН от 3,74 до 5,74. Значение рН = 6,5 лежит за пределами зоны действия ацетатного буфера, поэтому на основе ацетатной буферной системы такой буфер приготовить нельзя.
Буферная емкость.
Прибавлять кислоту или щелочь, существенно не меняя рН буферного раствора, можно лишь в относительно небольших коли-чествах, так как способность буферных растворов сохранять постоян-ство рН ограничена.
Величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, называется буферной емкостью (В).Различают буферную емкость по кислоте ( 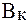 ) и по щелочи (
) и по щелочи ( 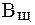 ).
).
Буферная емкость (В) измеряется количеством кислоты или щелочи (моль или ммоль эквивалента), добавление которого к 1 л буферного раствора изменяет рН на единицу.
На практике буферную емкость определяют титрованием. Для этого определенный объем буферного раствора титруют сильной кислотой или щелочью известной концентрации до достижения точки эквивалентности. Титрование проводят в присутствии кислотно-основных индикаторов, при правильном выборе которых фиксируют состояние, когда компонент буферной системы прореагирует полностью. По полученным результатам рассчитывают величину буферной емкости ( 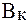 или
или 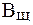 ):
):
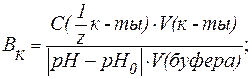
| (8) |
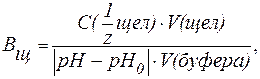
| (9) |
где С( 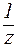 к-ты), С(
к-ты), С( 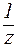 щел) - молярные концентрации эквивалента кислоты и щелочи (моль/л);
щел) - молярные концентрации эквивалента кислоты и щелочи (моль/л);
V(к-ты ), V(щел) - объемы добавленных растворов кислоты или щелочи (л; мл);
V(буфера) - объем буферного раствора (л; мл);
pH0 и pH - значения рН буферного раствора до и после титрования кислотой или щелочью (изменение рН берется по абсолютной величине).
Буферную емкость выражают в [моль/л] или в [ммоль/л].
Буферная емкость зависит от ряда факторов:
1. Чем больше абсолютное содержание компонентов пары основание/сопряженная кислота, тем выше буферная емкость буфер-ного раствора.
Буферная емкость зависит от соотношения количеств компо-нентов буферного раствора, а следовательно, и от рН буфера. Буфер-ная емкость максимальна при равных количествах компонентов бу-ферной системы и уменьшается с отклонением от этого соотношения.
3. При различном содержании компонентов буферные емкости раствора по кислоте и по щелочи отличаются. Так, в буферном растворе I типа чем больше содержание кислоты, тем больше буферная емкость по щелочи, а чем больше содержание соли, тем больше буферная емкость по кислоте. В буферном растворе II типа чем больше содержание соли, тем больше буферная емкость по щелочи, а чем больше содержание основания, тем больше буферная емкость по кислоте.
Пример 2. Для приготовления ацетатных буферных смесей растворы кислоты и соли одинаковой молярной концентрации были смешаны в следующих объемных соотношениях:
| Состав буферной системы | Объемные соотношения компонентов буферной системы | ||
| раствор I | раствор II | раствор III | |
| CH3COOH | |||
| CH3COONa |
Не прибегая к расчетам, определить, в каком из трёх буферных растворов будет наблюдаться:
а) наибольшее значение рН;
б) максимальная буферная емкость;
в) наибольшая буферная емкость по кислоте.
Решение.
В случае равных концентраций компонентов уравнение (5) принимает вид:
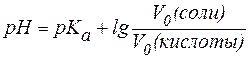 .
.
Так как 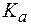 во всех трех растворах одинакова, то значение pH буфера будет определяться соотношением
во всех трех растворах одинакова, то значение pH буфера будет определяться соотношением 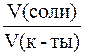 . Следовательно, наибольшим значением pH будет обладать I раствор (
. Следовательно, наибольшим значением pH будет обладать I раствор ( 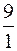 ):
):
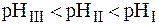
Максимальной буферной емкостью характеризуется II раствор, так как в нем соотношение количеств компонентов составляет 1:1.
Буферная емкость по кислоте для ацетатного буфера определя-ется содержанием сопряженного основания, т.е. соли: чем оно больше, тем больше буферная емкость раствора по кислоте. Поэтому:
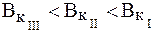
Таким образом, наибольшую емкость по кислоте будет иметь I раствор.
Дата добавления: 2015-12-22; просмотров: 19586;
