Механизм буферного действия
С точки зрения протолитической теории буферное действие растворов обусловлено наличием кислотно-основного равновесия общего типа:
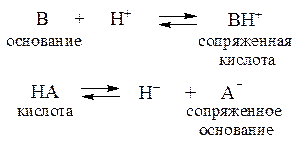
Сопряженные кислотно-основные пары А-/НА и В/ВН+ состав-ляют буферные системы.
Рассмотрим механизм буферного действия буферной системы на примере раствора, содержащего CH3COONa и СН3СООН. Уксусная кислота - слабый электролит, частично диссоциирующий на ионы:
СН3СООH ⇄ СН3СООН + H+
Ацетат натрия - сильный электролит, полностью распадающийся на ионы:
СН3СООNa  СН3СОО- + Na+
СН3СОО- + Na+
При добавлении сильной кислоты (например, НСl) сопряженное основание СН3СОО- связывает ионы Н+ в молекулы слабой кислоты:
СН3СОО- + H+  СН3СООН
СН3СООН
Таким образом, концентрация свободных ионов Н+ в растворе, а следовательно, и величина рН практически не изменяется.
Следует отметить, что при этом в буферной системе снижается концентрация анионов СН3СОО- и повышается концентрация моле-кул СН3СООН. В результате происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли и, как следст-вие, наблюдается незначительное изменение рН. Существенные отклонения значений pH (более чем на 1) наблюдаются в условиях практически полного (до 90%) расходования анионов СН3СОО-.
При добавлении сильной щелочи (например, КОН) усиливается диссоциация уксусной кислоты, поскольку выделяющиеся в раствор ионы Н+ реагируют с ионами ОН-, образуя воду:
СН3СООH + OH-  СН3СОО- + H2O
СН3СОО- + H2O
В этом случае также не происходит существенного изменения концентрации ионов Н+ в растворе, поскольку добавленные ионы ОН- оказываются связанными в молекулы слабого электролита - воды, но небольшое изменение в соотношении концентраций слабой кислоты и ее соли (уменьшение концентрации СН3СООН и увеличе-ние концентрации СН3СОО-) приводит к незначительному повыше-нию рН. Значительные отклонения значений pH (более чем на 1) наблюдаются в условиях практически полного (до 90%) расходования молекул кислоты.
Рассмотренные случаи показывают, что каждый компонент буферного раствора выполняет строго определенную функцию: за нейтрализацию добавленной кислоты «отвечают» анионы соли, а за нейтрализацию добавленной щелочи – молекулы кислоты.
Таким образом, для буферных растворов I типа справедливы заключения:
Чем больше концентрация соли, тем большее количество кис-лоты можно добавлять к буферу без существенного понижения рН.
Чем больше концентрация кислоты, тем большее количество щелочи можно добавлять к буферу без существенного повышения рН.
Механизм действия буферных систем II типа рассмотрим на примере раствора, содержащего аммиак и хлорид аммония.
Ъ/
,
-циирующим на ионы:
NH3∙H2O ⇄ NH4+ + OH-
NH4Сl  NH4+ + Cl-
NH4+ + Cl-
При добавлении сильной кислоты введенные в раствор ионы Н+ реагируют с ионами ОН-, образуя воду. При этом равновесие диссо-циации слабого основания смещается вправо, и в раствор переходит дополнительное количество ионов ОН-, компенсируя их затрату на реакцию. Поэтому значительного изменения рН не происходит, хотя из-за изменения соотношения между концентрациями основания и катиона наблюдается небольшое снижение рН.
При добавлении сильного основания равновесие диссоциации аммиака смещается влево, и добавленные в раствор ионы ОН- оказы-ваются связанными в молекулы присутствующими в растворе катионами NH4+, поэтому существенного отклонения рН не происхо-дит. Небольшое повышение рН связано с изменением соотношения между молекулами аммиака и катионами аммония в растворе.
Эти процессы описываются уравнениями:
NH3∙H2O + Н+  NH4+ + H2О;
NH4+ + H2О;
NH4+ + ОН- ⇄ NH3∙H2O,
из которых видно, что в буферной системе II типа каждый компонент также играет определенную роль: за нейтрализацию добавленной кислоты «отвечает» слабое основание, тогда как за нейтрализацию добавленной щелочи отвечает соль, создающая в растворе значитель-ную концентрацию катионов.
Таким образом, для буферных систем II типа можно заключить:
Чем больше концентрация слабого основания, тем большее коли-чество кислоты можно добавить к буферу без существенного снижения рН.
Чем больше концентрация соли, тем большее количество щелочи можно добавить к буферу без существенного повышения рН.
Значительное изменение рН буферного раствора произойдет только в том случае, когда большая часть одного или другого компо-нента раствора (более 90%) будет израсходована на связывание добавленных ионов в молекулы.
На основании приведенных примеров механизм буферного действия в общем случае можно определить следующим образом:
Буферное действие осуществляется за счет связывания добав-ляемых в раствор ионов Н+ или ОН- в малодиссоциированные соеди-нения в результате реакций этих ионов с соответствующими компонентами буферной системы.
Дата добавления: 2015-12-22; просмотров: 4321;
