Игра в Бога. Технологии создания ГМО, синтетическая биология, изменение генетического кода
Попытайтесь догадаться, чем занимается человек, которого я сейчас опишу, учитывая, что его история основана на реальных событиях. Наш герой находился в городе на берегу океана, где он зашел в магазин, чтобы купить пачку презервативов и детектор поддельных банкнот. Обе покупки понадобились ему только ночью, когда он в кромешной темноте находился на яхте недалеко от берега. Вскоре на яхту взошел береговой патруль, чтобы проверить документы таинственной личности в связи с весьма подозрительной активностью оной и ее подельников. Документы оказались в порядке, и патрульные удалились восвояси. Назовем этого человека Доктором М.
Вы удивитесь, но Доктор М – молекулярный биолог, университетский профессор. Он ныряет под воду с аквалангом в поисках кораллов. Эти родственники медуз флуоресцируют при свете герметично упакованного в презерватив детектора валют. Из полученных образцов Доктор М выделяет ДНК, чтобы потом открыть новые гены флуоресцентных белков. Иногда, прежде чем прочитать ДНК, нужно ее поймать! В этом амплуа Доктор М выступает как настоящий “мокрый" биолог. Так на жаргоне называют ученых-экспериментаторов, противопоставляя их “сухим" биологам – теоретикам и биоинформатикам, которые работают с готовыми данными.
Чайники для полимеразной цепной реакции, презервативы и ультрафиолетовые лампы – это далеко не все подручные средства, помогающие двигать науку вперед. Рассмотрим способ выделения ДНК, для использования на кухне или в баре, в процессе которого получается неплохой побочный продукт – съедобный алкогольный коктейль. Выделять ДНК мы будем из клубники. Культивируемая клубника Fragana ananassa приятна на вкус, и в то же время в ней немало ДНК. Размер генома клубники составляет 720 миллионов нуклеотидов299, при этом Fragana ananassa октоплоидная: каждая из семи хромосом представлена в клетках восемью копиями. Клубнику нужно поместить в морозилку, чтобы кристаллизация воды при образовании льда привела к разрушению клеток, а затем разморозить, чтобы содержимое клеток вытекло наружу.
Размороженную клубнику положим в полиэтиленовый пакет и добавим туда ананасовый сок (желательно свежий), содержащий большое количество фермента бромелина. Этот фермент является протеазой (протеиназой), то есть способен разрушать белки. От белков нам желательно избавиться, потому что некоторые из них могут разрушать ДНК. Концентрированная протеаза из ананаса используется для удаления омертвевшей ткани после сильных ожогов, а также для маринования мяса на шашлыки (мясо становится более мягким). Есть предположение, что ананасовый сок благодаря столь высокому содержанию протеаз улучшает пищеварение.
Содержимое пакета нужно как следует перемешать и размять, чтобы ДНК оказалась в растворе. От мякоти придется избавиться – для этого можно использовать марлю или дуршлаг. Жидкость, отфильтрованную от мякоти, переливаем в стакан и достаем очень крепкий алкоголь. Желательно, чтобы в нем было больше 70 % спирта. Это может быть крепкий абсент, американская водка Devil's Springs (75,5 % этанола), спирт Everclear (бывает с содержанием спирта 75,5 % и 90 %) или ром Bacardi 151 (75,5 % этанола). Внимание! Чрезмерное употребление алкоголя вредит вашему здоровью!
Алкоголь нужно добавлять в коктейль очень медленно, по краешку стакана. Желательная высота слоя спирта – несколько сантиметров. Ни в коем случае спирт не должен перемешиваться с соком. В спирте ДНК не растворяется, поэтому, если все сделать аккуратно, получится двухслойный напиток, а между слоями сформируются беловатые сгустки ДНК. Их можно подцепить палочкой и съесть. Все совершенно натурально!
Конечно, в лаборатории используют гораздо более стандартизованные и эффективные методы выделения ДНК. Быструю заморозку клеток можно осуществлять в жидком азоте. Кроме того, для разрушения клеточных оболочек можно использовать детергент (вроде моющего средства), например раствор Triton X-100. В детергент иногда добавляют соль, которая помогает ДНК слипаться. Вместо протеаз из ананасового сока для разрушения белков используют чистую протеиназу (чаще всего протеиназу К). Вместо дорогих алкогольных напитков берут обычный спирт. После добавления спирта раствор обычно охлаждают и помещают в центрифугу, где пробирка начинает вращаться со скоростью около десяти тысяч оборотов в минуту. Центробежная сила приводит к тому, что осадок (из ДНК) оказывается на нижней стенке пробирки. Потом жидкость из пробирки удаляется, а ДНК так и остается на дне. Подобные эксперименты в ряде стран проводят даже дети. Когда они подрастут, им разрешат использовать методы выделения ДНК для взрослых – с Bacardi и абсентом.
С генной инженерией не все так просто, как с выделением ДНК. Вам потребуется объект, который вы хотите модифицировать, например бактерия или растение, один из множества инструментов для генной модификации и, собственно, та конструкция из ДНК, которую вы хотите перенести. В качестве примера попробуем создать флуоресцирующую бактерию. Доктор М, а также другие ученые до него уже нашли для нас гены, которые кодируют флуоресцентные белки, и выложили их последовательности нуклеотидов в открытые базы данных, что существенно облегчает поставленную перед нами задачу.
В 1961 году японский ученый Осаму Симомура выделил из медузы рода Aequorea красивый биолюминисцентный белок, светящийся синим300. Позже было установлено, что у медузы есть еще один белок, работающий с ним в паре. Мы его уже упоминали в предыдущих главах. Этот белок поглощает свет в синем диапазоне, а излучает в зеленом. Его назвали GFP (green fluorescent protein, или зеленый флуоресцентный белок). Если биолюминисцентным белкам нужен исходный продукт (субстрат), с которым они вступают в химическую реакцию для получения света, то GFP в таком субстрате не нуждается. Как это часто бывает в области фундаментальных научных исследований, в последующие тридцать лет GFP оставался практически бесполезным и интересовал лишь узких специалистов, изучающих механизмы его флуоресценции. До тех пор, пока внезапно этому белку не нашлось важнейшее применение, перевернувшее наши представления о молекулярной биологии.
В 1992 году американский ученый Дуглас Прэшер с соавторами установили последовательность гена GFP301. К сожалению, ученому самым обидным образом не хватило финансирования, чтобы после продолжить изучение гена. Прэшер едва сводил концы с концами: какое-то время он даже ездил на машине с надписью “ученому нужна работа" и принимал пожертвования. Тем временем геном GFP независимо заинтересовались ученые Мартин Чалфи и Роджер Цянь. Прэшер, полагая, что сам с изучением GFP не справится, согласился передать ген коллегам для проведения дальнейших экспериментов.
Чалфи тоже не купался в деньгах, но обладал изобретательностью, которая очень помогла ему в исследовательской работе. Например, его лаборатория не могла позволить себе флуоресцентный микроскоп (чтобы наблюдать свечение GFP внутри отдельных клеток), поэтому Чалфи приглашал к себе торговцев лабораторным оборудованием, брал у них микроскопы на “испытательный срок", делал нужные снимки и анализы, а потом возвращал приборы обратно, так ничего и не купив.
В 1994 году Чалфи и его коллеги, включая Прэшера, опубликовали в журнале Science статью о том, что с помощью генной инженерии можно соединять ген GFP с другими генами живых организмов, а по свечению определять локализацию кодируемых ими белков302. Впоследствии благодаря GFP стало возможно увидеть под микроскопом, как развивается нервная система, как клетки поджелудочной железы, производящие гормон инсулин, организуются в ходе эмбрионального развития, как белки транспортируются в клеточное ядро или из ядра и вообще из одной части клетки в другую, как раковые клетки распространяются по телу человека и так далее.
Тем временем сотрудники лаборатории Цяня обнаружили в гене GFP мутации, из-за которых белок становился более ярким303, а также мутации, меняющие цвет флуоресценции белка. Благодаря его исследованиям арсенал ученых пополнился желтыми, оранжевыми, красными и другими флуоресцентными белками и их генами. Впоследствии решение Прэшера “поделиться” геном GFP с коллегами принесло великую пользу науке, но стоило ученому Нобелевской премии, на вручении которой он присутствовал почетным гостем, а не лауреатом. Премию за GFP разделили Цянь, Чалфи и Симомура, люди, успевшие внести наибольший вклад в его изучение, что не отменяет заслуг первооткрывателя гена. Последовательность исходного гена GFP Прэшера из оригинальной публикации вы можете увидеть ниже.

Кроме мутационного подхода для создания новых форм светящихся белков, который использовали в лаборатории Цяня, есть еще один способ – поиск уже существующих в природе генов флуоресцентных белков (как это делал Доктор М). С этим подходом преуспели в лаборатории академика Сергея Лукьянова из Института биоорганической химии РАН. Ученые открыли ярко-зеленый флуоресцентный белок на щупальцах актинии Anemonia majano, желтозеленый белок на щупальцах мягкого коралла рода Zoanthus, сине-зеленый белок на полосах и красный белок на пятнах дисков “грибного коралла” Discosoma striata и другие белки304. Позже эксперименты с различными флуоресцентными белками и их мутантами позволили создать белок, со временем меняющий цвет флуоресценции от зеленого к красному305. При помощи этого белка можно изучать, как меняется локализация или концентрация в клетке других белков, соединенных с такими светящимися “молекулярными часами”.
Еще одну замечательную идею с использованием флуоресцентных белков придумала группа молекулярных биологов из Гарварда во главе с Джефом Лихтманом и Джошуа Сейнсом. В 2007 году они опубликовали в журнале Nature статью о новом методе исследования связей между нервными клетками мозга – Brambow™ (от слов brain – “мозг” и rainbow – “радуга”, то есть “мозговая радуга”). Метод основан на том, что в результате особой рекомбинации в отдельных нервных клетках генетически модифицированного организма оказывается свой уникальный набор генов флуоресцентных белков. Разные соотношения красных, зеленых и синих белков создают уникальные цвета, поэтому отдельные нейроны и их отростки окрашиваются по-разному. Это позволяет создавать удивительной красоты изображения структур мозга и видеть, какие нервные клетки соединены отростками.
Но вернемся к нашей текущей задаче – создать работающую плазмиду с флуоресцентным геном. Сначала мы спланируем ее на компьютере, а потом рассмотрим, как получить соответствующую последовательность ДНК в пробирке. В конце мы перенесем плазмиду в бактерию. Давайте выберем предложенный ген GFP или его аналог, цвет и яркость которого нам больше подходят, и последуем дальше.
Кроме гена GFP, нам понадобится ген, придающий бактерии устойчивость к какому-нибудь антибиотику. Такие гены могут кодировать белки, разрушающие или инактивирующие антибиотик, не впускающие его в клетку и так далее. Примеров и механизмов устойчивости известно множество, причем от разных антибиотиков защищают разные механизмы. После того как мы генетически модифицируем наши бактерии, мы захотим избавиться от тех, которые модифицировать не удалось, и антибиотик нам в этом поможет.
Для того чтобы гены работали, к ним нужно подобрать правильные регуляторные участки – промоторы и операторы, о которых мы говорили, обсуждая “синтаксис жизни". Выбор промотора зависит от того, какой организм мы модифицируем и хотим ли мы, чтобы ген работал постоянно или при определенных условиях. У бактерий и эукариот РНК-полимеразы разные и используют разные промоторы. Для того чтобы ген работал в клетках бактерий, перед ним часто ставят промотор бактериофага T7. Бактериофаги пытаются заставить бактериальную клетку полностью переключиться на производство вирусных РНК и белков, поэтому их промоторы очень эффективные (сильные) – с прилежащих к ним генов считывается много РНК. Если мы используем промотор T7, в нашей плазмиде должен быть еще один ген, а именно ген РНК-полимеразы бактериофага Т7, которая будет этот промотор обслуживать (связывать). Этот ген можно поставить под обычный бактериальный промотор. Известно множество разных промоторов, как сильных, так и слабых, а их последовательности можно найти в открытых базах данных и в научных публикациях. Ниже приведена последовательность промотора T7.
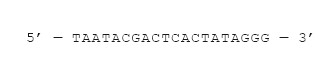
Для того чтобы синтез РНК в конце наших генов останавливался, после генов желательно разместить участки, которые называются терминаторами. Достигнув их, РНК-полимераза будет отсоединяться, прекращая синтез РНК. Это как знак пунктуации – точка в конце предложения. Для завершения работы над плазмидой потребуется еще один участок, который называется “ориджин репликации" – место, куда садится бактериальная ДНК-полимераза. Только при наличии такого участка плазмида сможет размножаться внутри бактерий. Наконец, между различными генами мы вставим небольшие участки ДНК произвольных последовательностей, чтобы отделить гены друг от друга.
Проект нашей плазмиды готов – пора создавать ее в пробирке. Сделать это можно несколькими способами. В принципе можно заказать плазмиду у какой-нибудь биотехнологической компании, которая сделает ее по нашим чертежам, используя современное оборудование и методы. Когда-нибудь в будущем устройства для синтеза произвольных последовательностей ДНК, в том числе плазмид, станут доступными для большинства людей, но пока что эти приборы очень дорогие. Здесь, конечно, ощущается некоторое жульничество. Что это за генные инженеры, которые не могут сами взять и все собрать?
Конечно, плазмиду можно собрать и самостоятельно, если она состоит из фрагментов других, уже готовых плазмид, геномов вирусов или бактерий, которые у нас хранятся в запаснике. Так поступали ученые, получившие от Прэшера ген GFP, – совмещали готовый ген с уже имевшимися генетическими конструкциями. Процесс сборки плазмиды можно сравнить с тем, как раньше писали анонимные письма, составляя тексты из слов, вырезанных из газет на свежем листе бумаги. Листом бумаги может выступить какая-нибудь существующая распространенная плазмида.
В арсенале генного инженера есть целый набор белков-ферментов, умеющих разрезать и сшивать молекулы ДНК. Как и GFP, эти ферменты были придуманы не учеными, а различными живыми организмами в процессе эволюции, а мы лишь позаимствовали их, приспособив под собственные нужды. Например, белок EcoR1, выделенный из кишечной палочки, относится к группе ферментов, разрезающих ДНК, которые называются рестриктазами. EcoR1 разрезает участок молекулы ДНК, если он выглядит так:

Причем разрезание происходит после буквы G верхней цепи и перед буквой G нижней цепи, как показано ниже.

Полученные концы молекул называются “липкими”, потому что они комплементарны друг другу и охотно готовы слипнуться обратно, но для того, чтобы их снова сшить вместе, нам потребуется еще один фермент – ДНК-лигаза. Ученые нашли уже сотни разных видов рестриктаз, которые могут разрезать совершенно разные фрагменты ДНК. Некоторые рестриктазы узнают короткие (часто встречающиеся) последовательности. С их помощью молекула ДНК будет разрезана сразу во многих местах, и получатся короткие фрагменты. Рестриктазы, узнающие длинные последовательности нуклеотидов, используются, чтобы разрезать ДНК на более крупные куски. Одни рестриктазы разрезают ДНК в том участке, который они непосредственно распознают, другие могут делать разрез на некотором расстоянии от узнаваемого ими места. Бывает, что рестриктазы оставляют не “липкие” концы, а “тупые”, как показано ниже.

Вырежем нужный нам фрагмент ДНК с помощью двух рестриктаз. Добавим вырезанный фрагмент к плазмиде, в которой были сделаны разрезы такими же рестриктазами. “Липкие” концы плазмиды и нашего фрагмента сблизятся по принципу комплементарности, а ДНК-лигаза их сошьет. В итоге мы получим плазмиду со вставкой.
Зачем бактериям рестриктазы и не могут ли они порезать свой собственный геном? Оказывается, что эти ферменты – отличное средство от чужеродной ДНК. Допустим, у бактерии есть рестриктаза, которая узнает фрагмент GAATTC и разрезает его. Сама бактерия пришла к такой рестриктазе постепенно, в процессе длительной эволюции, поэтому у нее в геноме крайне мало участков GAATTC. Кроме того, у нее могут быть особые ферменты, которые находят участки GAATTC и прикрепляют к ним метильные группы (из атома углерода и трех атомов водорода). Эта химическая модификация – она называется метилированием – защищает ДНК от действия некоторых рестриктаз.
Если же в бактерию проникнет неприспособленный бактериофаг, то, вероятно, в его геноме найдется незащищенный участок GAATTC и вирус будет беспощадно разрезан.
Для завершения задуманного генно-инженерного проекта понадобятся правильные бактерии. В обычных условиях менее одного процента бактерий готовы захватывать плазмиды. Для того чтобы увеличить эффективность передачи плазмид, бактерии стоит предварительно подвергнуть тепловому шоку. Сначала их держат в прохладных условиях, а потом ненадолго помещают в инкубатор с температурой в районе 42 градусов (разумеется, конкретные значения зависят от вида используемых бактерий). Многие бактерии в результате такого шока переключаются в особый режим, в котором они начинают хватать всякую ДНК из окружающей среды в надежде найти что-нибудь, что поможет им приспособиться и выжить. В природе это способствует повышению генетического разнообразия популяции бактерий, а значит, возрастают шансы, что какие-то особи переживут неблагоприятные условия. Вот таких напуганных бактерий мы и перемешаем с плазмидой, а затем с антибиотиком. Бактерии, захватившие плазмиду с правильной вставкой, обретут устойчивость и выживут, а остальные погибнут.
Генетически модифицированных бактерий мы можем размножать дальше и использовать в разных целях. Если речь идет не о научных, а о развлекательных задачах, то разбавленными бактериями с генами флуоресцентных белков можно рисовать на поверхности из застывшей питательной среды. Причем если вывести бактерий с флуоресцентными белками разных цветов, рисунки можно делать цветными. Нанесенные бактерии со временем размножатся, и, посветив ультрафиолетом на наш “холст”, мы увидим разноцветные картины. Подобные развлечения практикуются на занятиях в некоторых продвинутых зарубежных школах. Правда, обычно школьников не заставляют придумывать собственные плазмиды. Им предлагают уже готовые, проверенные плазмиды, с нужными генами и известным эффектом. Просто добавь бактерий! Подобным рисованием увлекаются не только дети, но и взрослые художники. В частности, создавались репродукции известных картин, таких как “Крик” Эдварда Мунка, “Большая волна в Канагаве” Кацусики Хокусая, “Звездная ночь” Винсента ван Гога, нарисованные при помощи бактерий.
Генетически модифицировать растения и животных с помощью плазмид проблематично. Дело в том, что для размножения плазмид внутри клеток должны присутствовать специальные белки. У бактерий они есть, но у растений и животных они отсутствуют. Мы можем засунуть бактериальную плазмиду в клетку и даже заставить ее гены работать, но если клетка будет делиться, со временем большинство ее потомков окажутся без плазмиды. Именно поэтому методы генной инженерии растений и животных чаще всего требуют внедрения конструкции непосредственно в геном.
В связи с этим пора перейти к более серьезному вооружению для генной модификации. Например, к генной пушке! Звучит фантастично, не правда ли? Похожим образом (согласно легенде) рассудили в компании Monsanto, когда к ним впервые пришли с такой идеей. Представители компании послали изобретателей на все четыре стороны, и эта ошибка обошлась впоследствии в миллионы долларов. В 1987 году в журнале Science вышла статья, доказывающая, что генная пушка реальна, работает и доставляет кусочки ДНК, содержащие гены, в живые клетки307. Первая генная пушка была похожа на ружье 22-го калибра, стреляющее холостыми патронами. Пороховой взрыв приводил в движение нейлоновый снаряд. Снаряд начинал двигаться вдоль ствола пушки, толкая перед собой микроскопические частички вольфрама, на которые нанесены фрагменты двухцепочечной ДНК. В конце ствола стояла стальная пластина, которая останавливала нейлоновый снаряд, а частицы с генами пролетали через отверстия в пластине диаметром в миллиметр каждое. Скорость полета частиц могла достигать тысячи километров в час! Пролетев сквозь клеточные стенки и мембраны, фрагменты ДНК, содержащие гены (со всеми необходимыми промоторами), начинали работать, а иногда, оказавшись рядом с наследственным материалом клеток, встраивались в их геном.
Генная пушка – это универсальный метод, позволяющий доставлять ДНК (или РНК) практически в любые клетки, будь то клетки животных, растений или бактерий. Основным недостатком метода до недавнего времени считалась стоимость генной пушки, которая могла доходить до 15 тысяч долларов. Однако “биохакер” Рюдигер Тройок создал ее упрощенный аналог ценой всего в 50 евро. Сначала он попробовал смастерить пушку, в основе которой лежали найденная в лесу деревянная палка, электрические клапаны (их он откопал в каком-то мусорном баке), капсула для накачивания велосипедных шин со сжатым углекислым газом, дешевый микроконтроллер и пластиковые трубки. Ствол пушки был сделан из корпуса пишущей ручки и с помощью трубки соединен с клапаном, внутри которого были расположены частички золота, смазанные ДНК и помещенные на пластиковый носитель.
Когда первый прототип не выдержал созданного в нем давления и сломался, Тройок просто соединил ствол своей генной пушки с распылителем для взбитых сливок (баллончик с веселящим газом, находящимся под давлением) – и готово. По заявлению Тройока, устройство могло придать частицам достаточную скорость для проникновения внутрь клеток лука. Конечно, эта пушка далека от совершенства, но сделать недорогую высококачественную генную пушку в принципе возможно, и скоро они появятся в широком доступе, если на них будет увеличиваться спрос.
Еще одна особенность генной пушки заключается в том, что фрагменты ДНК могут попадать в самые разные части клетки. В том числе в митохондрии, хлоропласты и другие внутриклеточные структуры. Это нежелательно, если мы хотим модифицировать ядерную ДНК клетки, но полезно, если мы хотим внести ген в сами митохондрии или хлоропласты308. Нежелательный эффект – обстрелянные из генных пушек клетки могут повреждаться. Какие-то клетки получат частички с ДНК, а какие-то мы просто повредим напрасно. Некоторым клеткам не достанется ни одной молекулы ДНК, а другим десятки. Наконец, ДНК встроится в геном лишь небольшой части клеток. Впоследствии придется тщательно отбирать те уцелевшие клетки, в которых генная модификация прошла успешно.
Обычно для генной инженерии растений выбираются особые клетки, которые называются каллусом. Каллус помещают в питательную среду, а потом подвергают обстрелу из генной пушки. Клетки каллуса многофункциональные, неспециализированные, из них можно получить целое растение путем вегетативного размножения. Если растение получено из генетически модифицированной клетки каллуса, оно будет целиком генетически модифицированным и станет давать соответствующее потомство.
В основе еще одного метода генной инженерии лежит использование почвенной агробактерии Agrobacterium tumefaciens. Ключевую роль в процессе генной модификации растительных клеток играет Ti -плазмида этой бактерии. Ее можно сравнить с маленькой передвижной подпольной лабораторией по генной инженерии, которую бактерия таскает с собой. Ti -плазмида кодирует целый арсенал белков, необходимых для доставки ДНК в растительную клетку, а также содержит особый участок, который называется Т-ДНК. Когда бактерия оказывается рядом с растительной клеткой, между ними образуется канал. Тем временем в бактерии создается копия Т-ДНК и синтезируются белки, которые связываются с Т-ДНК, помогают ей пройти по каналу внутрь растительной клетки, а дальше в ее ядро, где они создают разрезы в геномной ДНК растения и интегрируют Т-ДНК в одну из хромосом.
Бактериальные белки переносят не любую ДНК, а именно Т-ДНК, потому что она содержит особые последовательности, которые узнаются вышеупомянутыми белками Ti- плазмиды. В природе Т-ДНК содержит набор генов, которые, оказавшись в растительном геноме, заставляют клетки активно делиться и производить для бактерий питательные вещества. В результате на зараженных тканях растения образуются опухоли – корончатые галлы (в чем-то похожие на клубеньки). Но не стоит их путать с раковыми опухолями – там совсем другие молекулярные механизмы.
Как бы мы могли использовать замечательную способность агробактерий переносить свои гены в геномы растений? Можно взять Ti -плазмиду и убрать из Т-ДНК гены, вызывающие появление корончатых галлов309, а на их место вставить, например, ген Cry-токсина, который делает растение устойчивым к вредителям, или какой-нибудь другой ген, повышающий сельскохозяйственную ценность растения. Такую модифицированную Ti -плазмиду мы можем поместить внутрь агробактерии, а дальше агробактерия сама сделает свое дело – перенесет Т-ДНК в растительную клетку. Прелесть технологии в том, что Т-ДНК встраивается прямо в хромосому растения. Когда растительная клетка будет делиться, вставка будет размножаться и передаваться ее потомкам. Нам остается лишь использовать способность растений к вегетативному размножению, чтобы вырастить из небольшого числа клеток взрослый генетически модифицированный организм.
Стоит подчеркнуть несколько моментов, которые часто вызывают путаницу. Внутри растительных клеток ни на каком из этапов не присутствует вся бактериальная Тг-плазмида. Присутствует только ее часть – Т-ДНК. Вставка наследуется и передается потомкам растения даже при половом размножении. Вставка, используемая генными инженерами, больше не содержит опухолевых генов, поэтому у генетически модифицированных растений опухоли не появятся.
Для генной инженерии можно использовать не только бактерии и их плазмиды, но и вирусы. В предыдущих главах мы обсуждали способность некоторых вирусов встраивать копии своего генома в геномы клеток различных организмов. Но вирусы чаще всего вредны, а нам хочется переносить гены с минимальными побочными эффектами. Решить эту задачу помогает то обстоятельство, что вирусные частицы легко получаются из отдельных компонентов. Для создания вируса можно отдельно синтезировать вирусные белки (в каких-нибудь клетках), отдельно произвести копии его ДНК (если это вирус с ДНК-геномом) или РНК (если его геном из РНК), а потом смешать все это вместе в пробирке.
В вирусной ДНК (или РНК) присутствуют определенные последовательности нуклеотидов, необходимые для сборки вирусных частиц. Такие последовательности – что-то вроде “кодового слова”. Зная “кодовое слово”, мы можем снабдить им любую последовательность ДНК (или РНК) – например, нужный нам ген. Желательно только, чтобы конечная генетическая конструкция имела размеры, примерно соответствующие размеру вирусного генома. Мы можем отдельно синтезировать обрамленные “кодовыми словами” нужные нам гены, а потом смешать их с вирусными белками, необходимыми для сборки вирусных частиц. Полученные частицы будут взаимодействовать с клетками и доставлять в них нашу генетическую конструкцию, но не будут полноценными вирусами, так как в них нет опасных вирусных генов (а только необходимые нам). Зараженные клетки не будут производить новые вирусные частицы.
Напоследок у нас осталось еще одно, пожалуй, наиболее интересное и сложное оружие в руках генного инженера, за открытие которого, несомненно, дадут Нобелевскую премию. Я уже упоминал о нем, рассказывая про способность бактерий модифицировать свой собственный геном. Речь идет о CRISPR-системе. В 2000 году группа испанских био-информатиков обнаружила загадочное явление – скопление похожих друг на друга (повторяющихся) последовательностей в геномах многих прокариот310. Между повторяющимися последовательностями находились уникальные участки ДНК длиной в несколько десятков нуклеотидов, которые ученые назвали спейсерами. Представьте шахматную доску, где в одном ряду на черных клетках стоят различные фигуры, а на белых – одинаковые пешки. Повторяющиеся элементы оказались похожими даже в очень разных группах бактерий и архей, поэтому было выдвинуто предположение, что эти последовательности играют важную, но пока неизвестную роль в жизни прокариотических клеток.
В 2005 году три группы исследователей независимо обнаружили, что бактерии направленно встраивают небольшие фрагменты чужеродной ДНК (например, куски геномов бактериофагов) в свой геном в виде тех самых спейсеров311–313. Оказалось, что встраивание происходит в определенном месте бактериального генома, которое получило название “CRISPR-кассета”. Но для чего это бактериям? Группа эволюционного биолога Евгения Кунина (одного из самых цитируемых современных ученых и автора книги “Логика случая”) заинтересовалась вопросом о функциях спейсеров. Исследователи проанализировали имеющиеся генетические последовательности CRISPR-кассет и в 2006 году предсказали, что мы имеем дело с системой бактериального иммунитета314.
Как потом выяснилось, группа Кунина была права не только насчет функции CRISPR-кассет, но и насчет механизма работы бактериального иммунитета. Они предположили, что этот механизм похож на РНК-интерференцию эукариот. Напомню, что при РНК-интерференции короткие фрагменты чужеродной РНК используются особыми клеточными белками для поиска длинных чужеродных молекул РНК и их уничтожения. Аналогично CRISPR-система бактерий использует короткие фрагменты “направляющих РНК”, синтезированных со спейсеров, для обнаружения полноразмерных молекул ДНК бактериофагов.
Бактерии производят длинные молекулы РНК, содержащие последовательности всех спейсеров. Эти молекулы разрезаются на короткие фрагменты, каждый из которых соответствует ровно одному спейсеру. Полученные направляющие РНК помогают комплексу белков находить любые генетические последовательности, комплементарные спей-серу, например ДНК вирусов. Обнаруженные фрагменты после опознания разрезаются. Подобно антивирусным программам, бактерии регулярно пополняют свою “базу данных” спейсеров, когда сталкиваются с новыми бактериофагами (если переживают эту встречу).
Подтверждение роли CRISPR-системы в бактериальном иммунитете было опубликовано в 2007 году в журнале Science и принадлежит группе ученых из компании Damsco315. Исследователи хотели улучшить йогурт, защитив молочнокислые бактерии от бактериофагов, но волей случая внесли вклад в открытие одного из самых важных методов редактирования ДНК живых организмов.
В 2012 году в журнале Science вышла статья ученых из Медицинского института Говарда Хьюза, в которой было показано, что один из белков бактериальной CRISPR-системы (белок Casp) умеет разрезать молекулы ДНК в строго определенных местах316. Для этого достаточно предоставить ему специально подобранные направляющие РНК. Год спустя все та же группа исследователей опубликовала статью под названием “РНК-программируемое редактирование генома клеток человека"317. Оказалось, что белок Casp может работать и в клетках человека, если вместе с геном белка Casp внедрить в них ген, кодирующий направляющую РНК к какой-нибудь последовательности человеческой ДНК. Параллельно другая группа исследователей генетически модифицировала мышей с помощью Casp318. Но самое интересное было дальше.
Рассмотрим организм, у которого на одной из хромосом возникла новая мутация. Каждому потомку организма передается только одна родительская хромосома из пары, поэтому, если скрестить организм с мутацией (на одной хромосоме) и организм без мутации, половина их потомков унаследует генетическое изменение, а половина не унаследует. Если скрестить полученных потомков, несущих мутацию, друг с другом, четверть особей следующего поколения будет иметь мутацию на обеих хромосомах, половина на одной, а четверть окажется вовсе без мутации. Несложно заметить, что это классическое наследование (по Менделю) не очень эффективно в передаче нового “мутантного" варианта потомкам.

В 2015 году в журнале Science вышла статья с описанием “мутагенной цепной реакции”. МЦР – это новый метод быстрого редактирования геномов живых организмов на основе белка Casy 319. Он позволяет не только внести какую-то последовательность ДНК в определенное место генома, но и обойти вышеупомянутые законы наследования и добиться того, чтобы в результате скрещивания генетически модифицированного и обычного организма получались только генетически модифицированные потомки, причем с мутацией сразу на обеих копиях хромосомы. Как это сделать?
Мы выбираем место, которое хотим редактировать, и ген, который хотим вставить. Создаем плазмиду, содержащую целевой ген, ген белка Casy и ген специально подобранной направляющей РНК, распознающей желаемое место вставки. Все это обрамляется двумя последовательностями ДНК, комплементарными участкам хромосомы предшествующему и следующему за местом разреза разреза (будущим местом вставки). Плазмида с такой конструкцией переносится в клетку. Внутри клетки синтезируется белок Casy, который связывает направляющую РНК и делает двухцепочечный разрез в комплементарном ей участке одной из хромосом. Клетки не любят разрезы в ДНК (а точнее, “оголенные” концы этих молекул) и пытаются их исправить, снова сшить молекулы.
Иногда для исправления разреза подключается особый клеточный механизм починки ДНК, который в поисках информации о том, как выглядела молекула ДНК до разреза, может обратиться ко второй копии хромосомы. Используя эту информацию, механизм, названный гомологичной рекомбинацией, может проверить, не пропало ли что-нибудь в месте разреза, и восстановить недостающие нуклеотиды.
Если клетка использует для починки вторую копию хромосомы или просто сошьет концы вместе, ничего не изменится. Белок Casy снова сделает разрез, и клетке придется чинить ДНК заново.
С другой стороны, на копию хромосомы очень похожа наша плазмида, так как у нее есть обрамляющие участки, точно совпадающие с участками вокруг разреза! Из-за этих участков система починки ДНК может перепутать плазмиду со второй копией хромосомы и синтезировать копию нашей конструкции (с целевым геном, геном Casy и геном направляющей РНК) в место разреза. Когда вторая копия хромосомы будет разрезана все тем же белком Casy, “дырка” в ДНК исправится за счет копирования участка с первой (уже генетически модифицированной) копии хромосомы или участка с нашей плазмиды. В любом случае обе хромосомы окажутся с нужной нам вставкой.
Когда наша генетически модифицированная хромосома передастся потомку организма, в его клетках тоже будут синтезированы белок Casy и направляющая РНК. В результате вторая копия хромосомы, доставшаяся от другого родителя, тоже будет изменена. Получается, что генетически модифицированная хромосома превращает немодифицированные копии хромосомы в себе подобные, а вставка очень эффективно распространяется в популяции. Если организм с такой вставкой выпустить в окружающую среду, шансы, что вставка распространится, будут очень высоки. А значит, такой подход теоретически можно использовать для инженерии природных популяций – например, для борьбы с разносчиками инфекций.
Представьте, что мы создадим генетически модифицированных комаров, не переносящих малярию из-за внесенного в их геном изменения, но способных скрещиваться с обычными малярийными комарами. Выпустив таких комаров в окружающую среду, мы сможем запустить мутагенную цепную реакцию и преобразовать популяцию опасных кровососущих насекомых в безобидных кровососущих насекомых. Новый генетический вариант со временем вытеснит старый.
Другое теоретическое применение технологии – избавление человечества от наиболее распространенных наследственных заболеваний. Мы можем не просто исправить дефект в ДНК, но сделать так, чтобы хромосома, доставшаяся ребенку от генетически модифицированного родителя, исправляла аналогичный дефект на хромосоме, доставшейся ему от второго родителя. Это значит, что можно свести к минимуму число вредных и опасных мутаций в нашей популяции и значительно уменьшить риск большинства генетических заболеваний. Однако это уже будет довольно опасный эксперимент, ведь CRISPR/Casy может не только исправить дефекты, но и внести по ошибке какие-то новые нежелательные мутации в геном.
В 2015 году ученые из лаборатории репродуктивной медицины Университета Сунь Ятсена в Китае опубликовали в журнале Protein Cell результаты изменения ДНК эмбрионов человека с помощью CRISPR/Casy системы320. Ученые показали, что можно направленно редактировать геном человеческих эмбриональных клеток, однако метод CRISPR/Casy был недостаточно эффективным и точным – нежелательное редактирование происходило в разных частях генома. Тем не менее принципиальная возможность генной инженерии людей таким методом была продемонстрирована.
Хотя никто не собирался выращивать генетически модифицированных людей из этих (заведомо нежизнеспособных) эмбрионов, публикация вызвала огромный общественный резонанс, и целый ряд стран ввел запреты на такое использование технологии. Тем лучше для Китая – если они достигнут успеха в этой области, то в будущем богатые люди, желающие завести генетически модифицированных детей, просто наведаются к ним “в гости” и внесут ощутимый денежный вклад в развитие китайской биомедицины.
Конечно, генная модификация людей сильно отличается от генной инженерии других организмов тем, что мы не можем позволить себе риск рождения несчастного ребенка-мутанта из-за ошибки технологии. Это не генетически модифицированные растения и бактерии, которых мы можем легко выкинуть и заменить, если что-то пойдет не так. Собственно, при обычной генной инженерии мы тоже получаем организмы, у которых вставка произошла не там, где надо, но мы можем создать сотни разных генетически модифицированных особей, прочитать их ДНК и отобрать удачные варианты, с которыми все в полном порядке.
Но можно ли проводить редактирование ДНК более точно? Направляющая РНК позволяет белку Casy узнать в геноме фрагмент ДНК длиной около двадцати нуклеотидов. Для узнавания не требуется 100 % комплементарно-сти между направляющей РНК и геномным фрагментом, поэтому Casy иногда режет не там, где предполагалось, – с этой проблемой и столкнулись китайские ученые, пытавшиеся редактировать геном эмбриона человека. Но еще в 2013 году в журнале Cell вышла статья, в которой было предложено усовершенствование белка Casy, позволяющее существенно снизить вероятность ошибки.
Авторы статьи получили мутантный вариант Casy, который разрезает не две цепочки молекулы ДНК, а только одну321. Казалось бы, как такой “испорченный” фермент сможет работать лучше обычного? Дело в том, что вместе с мутантным Casy используется не одна направляющая РНК, а две, узнающие два соседних участка ДНК. Система починки ДНК в клетке легко “запаивает" одноцепочечный разрез в молекуле ДНК, но если такой разрыв произойдет одновременно в двух соседних местах обеих цепей, мы получим эффект, аналогичный действию ферментов рестриктаз, с разделением одной молекулы ДНК на две (места разрезов показаны символом <>).

Теперь для редактирования генома недостаточно, чтобы одна направляющая РНК узнала какой-то его участок. Нужно, чтобы две направляющие РНК узнали два соседних участка генома. Такая система редактирования генома узнает не 20 нуклеотидов, а 40, а значит, специфичность метода существенно возрастает. Еще более надежный метод был предложен в 2014 году в журнале Nature Biotechnology сразу двумя группами исследователей322, 323. Существует белок, который называется нуклеаза FokI, способный разрезать ДНК. Белки FokI разрезают ДНК только в том случае, если два таких белка соберутся вместе, образуя “супербелок”. Примерно как в детских мультиках, где непобедимый робот собирается из нескольких маленьких роботов, каждый из которых по отдельности не может одолеть врага.
Ученые взяли и приделали одиночный белок FokI к модифицированному белку Casy, который из-за внесенной в него мутации вовсе лишен способности разрезать ДНК, но по-прежнему может ее узнавать при помощи направляющей РНК. С помощью одной направляющей РНК гибридный белок Casy-FokI узнает один участок ДНК, но не может его разрезать (ни одну цепочку). С помощью другой направляющей РНК он может узнать второй участок ДНК, но тоже не может его разрезать. Но если два гибридных белка Casy-FokI окажутся рядом, узнав два соседних участка ДНК (расположенных на строго определенном расстоянии), белки FokI образуют “супербелок” и могут разрезать ДНК. Преимуществ у подхода два: мы больше не вносим лишние одноцепочечные разрезы в ДНК и одновременно фиксируем расстояние, на котором должны находиться два участка ДНК, узнаваемые Casy и направляющими РНК. С другой стороны, это несколько ограничивает применимость метода – не любой участок ДНК содержит сайт, который может разрезать FokI.
Создание новых способов редактирования генома – одна из самых бурно развивающихся областей современных биотехнологий. Вполне возможно, что к моменту издания этой книги многие из описанных методов уже устареют, а им на замену придут новые, еще более точные и надежные подходы. Например, пока я писал эту главу, ученые из Гарварда опубликовали статью про новую мутантную форму белка Casy, в 25 раз более специфичную, чем та, что была обнаружена в природе у бактерий324. Кроме того, было найдено вещество, увеличивающее эффективность редактирования генома с помощью Casy в 17 раз325. Аналогично были обнаружены гены, временно выключая которые с помощью РНК-интерференции, удается повышать эффективность редактирования генома в 8 раз326. Последние два подхода направлены на то, чтобы заставить клетки исправлять сделанные с помощью Casy разрезы в ДНК именно через рекомбинацию (с похожей молекулой ДНК), а не через простое сшивание молекул в месте разреза. Еще две группы ученых получили мутантный белок Casy, который редактирует ДНК только после активации светом327, 328.
Еще одна группа исследователей показала, что с помощью CRISPR-системы можно получать генетически модифицированные сперматозоиды крыс, а значит, менять геномы животных, не затрагивая эмбрионы329. Вполне вероятно, что первые генетически модифицированные люди получатся благодаря использованию этого подхода. Надеюсь, что общество не будет выступать против опытов с ГМ спермой, как выступает сейчас против генной инженерии эмбрионов. Если и сперматозоиды приравнять к взрослым людям, то придется обвинить каждого половозрелого мужчину в регулярном геноциде. А некоторых их сообщниц – в каннибализме.
С точки зрения маркетинга метод CRISPR/Casy имеет любопытное преимущество по сравнению с другими методами генной инженерии. Помните, мы обсуждали разницу между мочевиной и карбамидом в восприятии обывателя? А теперь сравните: “продукт содержит ГМО” и “продукт улучшен с использованием белков природного бактериального иммунитета молочнокислых бактерий из йогурта”. Второй вариант не только звучит привлекательнее, он и куда информативнее!
Итак, мы научились менять гены живых организмов, но понимаем ли мы устройство геномов живых существ настолько хорошо, чтобы создавать их с нуля? Здесь мы возвращаемся к возможности синтезировать любую молекулу ДНК заданной нуклеотидной последовательности в пробирке. В 2010 году ученый Крейг Вентер, которого мы уже упоминали в связи с его успешным проектом по чтению генома человека и оригинальной идеей прочитать “геном” Саргассового моря, объявил на страницах журнала Science, что его команда создала клетку с синтетической ДНК330. Новость моментально разлетелась по всему миру, а журнал Newsweek разместил на своей обложке фотографию Вентера с заголовком Playing God (“Играя в Бога”).

Синтетическая ДНК ничем не отличается от обычной, кроме своего происхождения. Ее не скопировала с уже готовой цепочки ДНК-полимераза. Вместо этого использовался химический синтез – последовательное соединение нуклеотидов в пробирке. Выстраивая цепочку ДНК мономер за мономером, можно синтезировать фрагменты длиной до тысячи нуклеотидов. Такие фрагменты можно сшить друг с другом, например с помощью ДНК-лигаз.
Но сначала Вентер и его команда спроектировали будущий геном на компьютере. Речь шла о создании бактерии под названием Mycoplasma laboratorium (микоплазма лабораторная), и в основу ее генома лег геном Mycoplasma geni-talium, паразитической бактерии, обитающей в половых и дыхательных системах приматов. Напомню, что это бактерия с одним из самых маленьких геномов (582970 нуклеотидов).
В геном бактерии были вставлены особые “водяные знаки” в виде зашифрованных нуклеотидами посланий. Среди посланий были цитата знаменитого физика Ричарда Фейнмана (“Я не понимаю того, чего не могу создать”), слова ирландского поэта Джеймса Джойса (“Жить, заблуждаться, падать, торжествовать, воссоздавать жизнь из жизни”) и высказывание, приписываемое американскому физику-теоретику Роберту Оппенгеймеру (“Видеть мир не каким он является, а каким он мог бы быть”). Полученную молекулу ДНК затем перенесли в бактериальную клетку, из которой предварительно вынули ее собственную хромосому.
С первого раза “запустить” жизнь с синтетической хромосомой команде Вентера не удалось. Внесенная ДНК не была защищена метильными группами от действия рестриктаз, находящихся внутри донорской бактериальной клетки. Тогда ученые обработали свою синтетическую ДНК ферментами – метилазами, которые устранили этот недостаток. После этого ДНК успешно перенесли, а полученные бактериальные клетки с новой хромосомой питались, росли и делились330.
Создание организма с синтетической хромосомой обошлось в общей сложности примерно в 40 миллионов долларов. Главный результат проекта – демонстрация принципа, что мы можем синтезировать функциональные молекулы ДНК достаточно большой длины с произвольной нуклеотидной последовательностью. Для практических целей, конечно, можно использовать куда более простые подходы к созданию новых форм жизни и сильно сэкономить. С другой стороны, это не совсем создание синтетической жизни. Нам еще предстоит многое изучить, прежде чем мы сможем проектировать совсем новые организмы, ведь полученная микоплазма – это все-таки обычная микоплазма, просто с весьма необычной историей происхождения.
Создание синтетической ДНК – довольно странный опыт в том смысле, что всем молекулярным биологам и без него было очевидно, что эксперимент удастся. Но этот опыт очень важен для популяризации в широких массах идеи, что ученые действительно неплохо понимают, как работает генетический аппарат клеток.
Как можно зашифровать текстовое послание с помощью молекулы ДНК, легче всего показать на примере арт-проекта “Зарождение" (Genesis) американского художника Эдуарду Каца, деятельность которого находится на стыке между искусством и популяризацией современной науки. Самый известный проект Каца – создание декоративного светящегося кролика (с геном GFP медузы) и светящихся аквариумных рыбок (сегодня их может приобрести любой желающий). Проект Genesis, как и многие другие проекты художника, был посвящен генной инженерии. Кац сделал бактерию, в геноме которой была записана следующая цитата из Книги Бытия на английском языке: Let man have dominion over the fish of the sea and over the fowl of the air and over every living thing that moves upon the earth (“И да владычествует человек над рыбами морскими, и над птицами небесными, и над скотом, и над всею землею, и над всеми гадами, пресмыкающимися по земле”). Сообщение было переведено в азбуку Морзе:

После этого нуклеотидом Т было закодировано “тире”, нуклеотидом C – “точка”, нуклеотидом G – “разделение букв”, нуклеотидом A – “разделение слов”. В итоге получилась следующая последовательность нуклеотидов:

Кац позволил бактериям с такой вставкой немного пожить и накопить мутаций, а затем прочитал этот фрагмент ДНК и перевел мутировавший фрагмент обратно на английский. Вот что у него получилось: Let aan have dominion over the fish of the sea and over the fowl of the air and over every living thing that 10ves ua eon the earth (“И да владычествует хеловек над рыбами морскими, и над птицами небесными, и над скотом, и над всею землею, и над всеми гадами, преснокающимися про земле”). Мы видим, что в этой фразе появились ошибки – еще одна иллюстрация метафоры, что молекула ДНК – это, в сущности, текст, но текст, который может меняться.
Одно из возможных практических применений организмов с “минимальными” синтетическими хромосомами – создание эффективных производителей питательных веществ или биотоплива. Нехватка последнего остро ощущается с давних времен. “Во время Второй мировой войны Германия использовала спирт в качестве топлива для ракет Фау-2”, – рассказывал в своих мемуарах генерал Вальтер Дорнбергер, руководивший ракетно-исследовательским центром в Пенемюнде. Фау-2 создавались под его административным руководством и техническим руководством знаменитого немецко-американского ученого и конструктора ракет Вернера фон Брауна. Алкоголя хватало для медицинских и пищевых целей, но никому даже в голову не приходило, что в промышленных масштабах имеющееся количество спирта ничтожно. Когда Гитлер настаивал на увеличении производства Фау-2, Дорнбергер отвечал: “У нас нет столько спирта”. Возможно, что именно для борьбы с вражескими мощностями по производству спирта, получаемого в значительном количестве из картофеля, Германия разрабатывала во время Второй мировой войны энтомологическое оружие – сбрасываемых с самолетов колорадских жуков (история слишком необычная, чтобы о ней умолчать, но есть вероятность, что это всего лишь легенда).
Современные попытки использовать растения для промышленного создания биотоплива имели определенные нежелательные эффекты, такие как рост цен на продовольствие. Проиллюстрировать эту проблему нам поможет отрывок из романа Томаса Майн Рида “Квартеронка". Еще сто пятьдесят лет назад автор предвидел не только появление биотоплива, но и последствия попыток его массового применения.
“К сожалению, должен сказать, что теперь уж нет надежды обогнать “Магнолию”. Мы с ней в неравном положении. Она бросает в топки копченые окорока, которые заготовила на этот случай, а я после того, как обещал вам не участвовать в гонках, не погрузил ни одного. Бессмысленно начинать гонку только на дровах…” – так описывал гонку двух пароходов Майн Рид. Положение отстающего парохода спасла пассажирка, которая везла груз окороков. “Окорока были куплены для моих людей на плантации, но они им пока не нужны”, – заявила дама. Реальность такова, что переход на выращивание технических культур для выработки биотоплива приводит к увеличению цен на продовольствие. Сцена с гонкой пароходов примечательна и своей концовкой: “Раздался треск, во все стороны посыпались доски, люди с пронзительными криками взлетели вверх, дым и пар застлали все кругом, и ужасный вопль сотен голосов раздался во мраке ночи”. Взорвался паровой котел.
Надежда на то, что производство биотоплива можно сделать эффективным и выгодным, возродилась вместе с созданием ГМ бактерий, обладающих искусственными метаболическими путями331. Продукты жизнедеятельности таких бактерий можно использовать для создания биотоплива разного качества, в том числе пригодного для запуска ракет332. Но и здесь возникает проблема налаживания эффективного промышленного производства.
Проблема при использовании многих существующих микроорганизмов заключается в недостаточной эффективности их метаболизма. У них слишком много лишних генов и слишком большие геномы, на воспроизводство которых уходит много энергии. Для того чтобы сделать по-настоящему эффективного производителя, было бы полезно создать “минимальный" организм, содержащий лишь самые важные гены. Впоследствии его можно было бы вооружать генами нужных метаболических путей в зависимости от того, что мы хотим производить.
Для таких целей команда ученых из Венгерской академии наук разработала упрощенную кишечную палочку, из генома которой удалены многие ненужные фрагменты ДНК. В одной из первых работ они смогли сократить количество генов на 9,3 %, уменьшить размер генома на 8,1 %, в том числе убрав из него 24 из 44 мобильных элементов (транспозонов)333. Устранение последних особенно полезно при создании стабильных штаммов бактерий-производителей, так как транспозоны могут, перескакивая из одного участка генома в другой, создавать лишние мутации, нарушая работу встроенных в бактерию генов. Позже ученым удалось избавиться и от многих других элементов генома кишечной палочки, уменьшив его размер аж на 15 %334. Полученные бактерии имели целый ряд преимуществ с точки зрения их последующего направленного генетического улучшения – например, в них было легче переносить новый генетический материал.
Еще одна ключевая публикация в области создания новых форм жизни вышла в 2014 году в журнале Nature. Ученые из Исследовательского института Скриппса показали, что можно менять не только нуклеотиды в геноме, но даже “алфавит” молекулы ДНК. В своей работе под названием “Полусинтетический организм с расширенным генетическим алфавитом”335 исследователи добавили к двум комплементарным парам нуклеотидов еще одну: в новой двойной спирали, которую получили ученые, нуклеотиды с названием dySICS стоят напротив нуклеотидов dNaM.
Кишечная палочка, в которую ввели такую необычную ДНК, не умеет синтезировать эти новые типы нуклеотидов, но если ее “подкармливать” ими, добавляя в питательную среду, бактерия успешно использует их при репликации ДНК. При этом нуклеотиды dySICS и dNaM внедряются ДНК-полимеразой друг напротив друга, как если бы это была обычная комплементарная пара нуклеотидов. Такая новая ДНК может передаваться от родительских клеток потомкам, но на сегодняшний день она абсолютно “бесполезна”. С нее не считывается какая-то особая РНК, она не кодирует никаких белков, но в будущем ей вполне может найтись применение. Во-первых, не исключено, что эта технология поможет создавать генетически модифицированные организмы, чьи гены будут сохраняться, только если подкармливать их “особыми” нуклеотидами. Такие гены заведомо не “убегут” в окружающую среду, не окажутся перемещены в результате горизонтального переноса и так далее.
Кроме того, имея 6 разных нуклеотидов, мы можем теоретически иметь для кодирования аминокислот не 64 кодона, а 216. Тут сразу возникает вопрос: если даже число имеющихся кодонов избыточно и ими кодируется всего 20 аминокислот, то зачем нам еще больше? Но допустим, что мы хотим создать в клетке белок, в состав которого входит какая-то нестандартная аминокислота. Использовать какой-то из уже имеющихся кодонов для кодирования этой аминокислоты нежелательно, ведь в геномах живых организмов встречаются все кодоны. Чтобы не испортить кучу белков, нам придется сначала какой-то кодон “освободить", заменив в геноме большинство таких кодонов на другие кодоны, отвечающие за ту же самую аминокислоту. А это технически достаточно сложная задача! Даже если мы будем синтезировать молекулы ДНК “с нуля”, как это делал Вентер. Альтернативно можно использовать один из стоп-кодонов, но стоп-кодонов всего три, и они тоже нужны. Зато с новой нуклеотидной парой мы сразу получим уникальный кодон, которому можно приписать любую аминокислоту. При этом мы не затронем работу других генов и последовательности белков, которые они кодируют.
Что значит “приписать” кодону новую аминокислоту? Ранее мы разбирали, что важную роль в работе генетического аппарата клетки играют транспортные РНК (тРНК), которые, с одной стороны, несут аминокислоту, а с другой – имеют три нуклеотида, комплементарные кодону молекулы РНК. Такие тРНК по очереди связываются с рибосомой в процессе синтеза белка и привносят соответствующие кодонам молекулы РНК аминокислоты.
Какую аминокислоту несет та или иная тРНК – это, в свою очередь, определяется специальными ферментами, которые называются аминоацил-тРНК-синтетазами. Организму нужно как минимум 20 разных аминоацил-тРНК-синтетаз – по одной на каждую аминокислоту, кодируемую в рамках стандартного генетического кода. Каждая аминоацил-тРНК-синтетаза присоединяет одну-единственную аминокислоту к соответствующим тРНК.
Если мы хотим изменить генетический код клетки и приписать какому-то кодону новую аминокислоту, нам нужно внести в геном этой клетки новую пару тРНК и аминоацил-тРНК-синтетазы. Новой тРНК необходимо узнавать нужный нам кодон (но не другие кодоны). Кроме того, эту тРНК не должны распознавать уже имеющиеся в клетке аминоацил-тРНК-синтетазы. В свою очередь, новой аминоацил-тРНК-синтетазе нужно узнавать привнесенную тРНК, но не другие тРНК клетки. Наконец, нам необходимо как-то накормить клетку новой нестандартной аминокислотой, а для этого аминокислота должна проникать внутрь клетки. Но даже с этой нелегкой задачей ученые справились.
Создать кишечную палочку с измененным генетическим кодом удалось в 2001 году в лаборатории Питера Шульца все в том же Институте Скриппса. Ученые приписали одному из трех стоп-кодонов нестандартную аминокислоту L-метокситирозин78. Вы могли уже заметить, что для решения своих задач генные инженеры почти всегда обращаются за поиском готовых решений к природе. В данном случае пару тРНК и аминоацил-тРНК-синтетазы ученые позаимствовали из другого вида бактерий, немного изменили их с помощью генной инженерии и подвергли искусственному отбору, чтобы добиться хорошего и специфичного присоединения новой аминокислоты. Ученым удалось показать, что новая аминоацил-тРНК-синтетаза избирательно присоединяет именно L-метокситирозин в том месте, где у обычной бактерии срабатывал бы тот самый замененный стоп-кодон, и вставить новую аминокислоту в несколько важных белков.
Кто-то подумает, что это все лишь красивые игры ученых, не имеющие прямого отношения к нашей повседневной жизни, – и будет не прав. Уже сейчас мы умеем переносить готовые гены из генома одного организма в геном другого, создавать любые последовательности ДНК, менять саму ДНК и даже самые фундаментальные основы жизни – генетический код. Эти технологии в конечном итоге позволят исправить многие несовершенства окружающего нас мира: побороть голод, избавиться от наследственных заболеваний, от которых страдают взрослые и дети, продлить людям жизнь. “Играем ли мы в Бога?" – спросите вы. Не думаю, что мы конкурируем с ним в этих задачах. Во всяком случае, я не вижу, чтобы Бог решал за нас перечисленные проблемы. Вот мы и вынуждены справляться сами.
Глава 14
Дата добавления: 2015-12-10; просмотров: 1714;
