Инверсионная вольтамперометрия
Метод инверсионной вольтамперометрии заключается в предварительном электроконцентрировании (при постоянном потенциале) определяемого вещества на поверхности индикаторного электрода и последующим электроснятием выделившегося на электроде вещества в вольтамперометрическом режиме. Электронакопление проводят при потенциале предельного тока деполяризатора и энергичном перемешивании раствора в течение какого-то строго контролируемого времени. По истечении заданного времени раствору дают успокоиться (несколько секунд), затем включают развертку потенциала и регистрируют вольтамперограмму, которая имеет форму пика (рисунок).
| Развертка потенциала (а) и изменение тока (б) при регистрации анодной инверсионной вольтамперограммы на стационарном ртутном электроде |
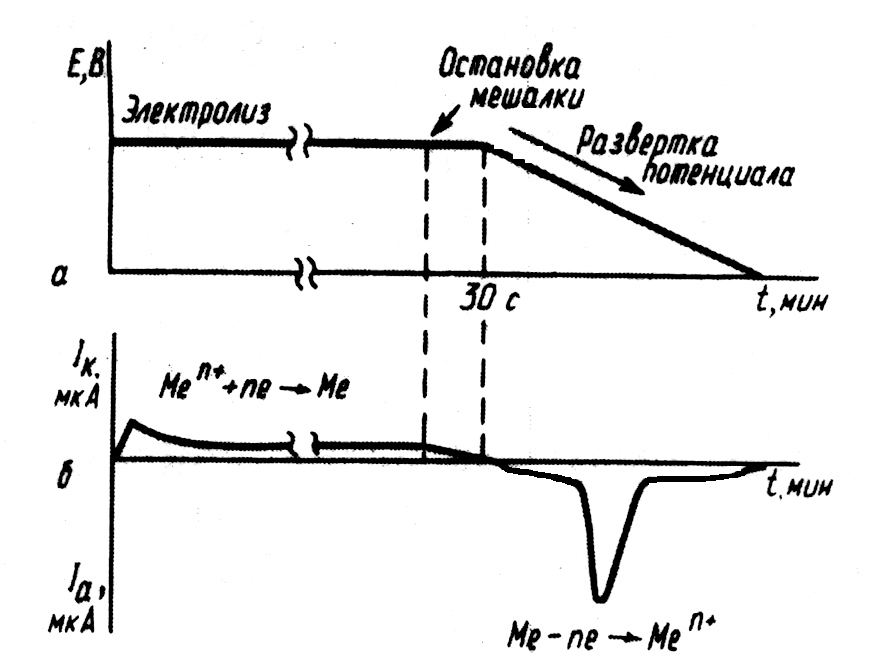
|
| Анодная инверсионная вольтамперограмма образца речной воды, содержащей 0,5 мкг/л кадмия, 5 мкг/л меди и по 15 мкг/л цинка и свинца (предварительный электролиз проводили при –1,2 В на пленочном ртутно-графитовом электроде в течение 5 мин) |
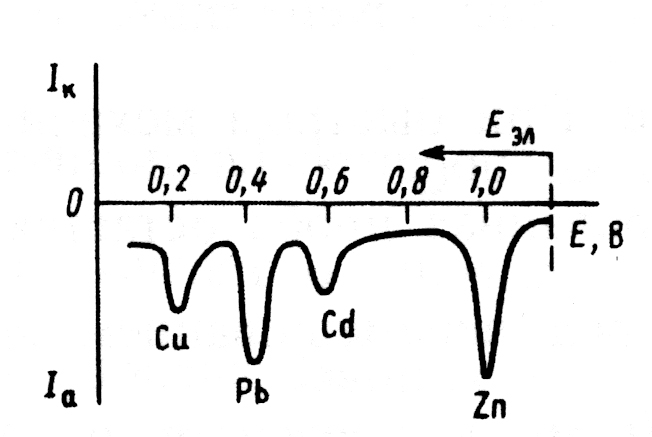
|
Величина тока пика линейно зависит от ряда факторов: интенсивности перемешивания раствора, времени электроконцентрирования, скорости развертки потенциала (скорости регистрации вольтамперограммы), концентрации деполяризатора в растворе. При постоянных условиях электроконцентрирования и регистрации вольтамперограммы величина тока пика линейно зависит от содержания вещества в растворе:
Iп = КС
Потенциал пика (Еп) инверсионной вольтамперограммы близок к численному значению потенциала полуволны (Е1/2) прямой вольтамперограммы.
В инверсионной вольтамперометрии используется широкий круг индикаторных электродов, которые обладают различными электрохимическими и физико-химическими свойствами.
Амперометрия
Вольтамперометрию широко используют для индикации точки эквивалентности (конечной точки титрования – ктт) при титровании. Поскольку регистрируемым аналитическим сигналом при этом является ток, то такое титрование называют амперометрическим. Амперометрическое титрование проводят при потенциале, соответствующем предельному диффузионному току деполяризатора – участника химической реакции, и регистрируют изменение тока в процессе титрования. По кривой зависимости «ток – объем титранта» (I ÷ V) находят точку эквивалентности (ктт). В таком варианте для титрования используют установку с одним рабочим (индикаторным) электродом, поэтому этот метод называют амперометрическим титрованием с одним индикаторным электродом.
Амперометрическое титрование возможно при использовании химической реакции, отвечающей требованиям титриметрии, в ходе которой в объеме титруемого раствора изменяется содержание электроактивного компонента, а следовательно, в соответствии с уравнением Ильковича, предельный диффузионный ток его восстановления или окисления. Взаимосвязь между вольтамперными кривыми электроактивного определяемого вещества и кривой зависимости предельного тока от объѐма электронеактивного титранта приведена на рисунке:
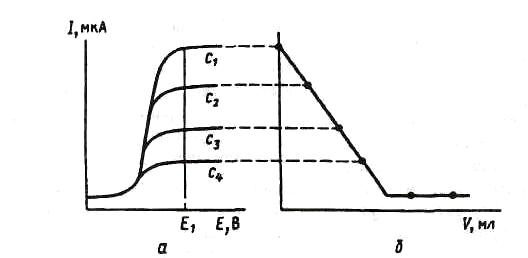
При уменьшении в ходе титрования до точки эквивалентности концентрации электроактивного определяемого вещества на кривой амперометрического титрования наблюдается линейное уменьшение тока, а после точки эквивалентности накапливание в растворе избыточного электронеактивного титранта не приводит к изменению тока.
Кривая амперометрического титрования, как правило, состоит из двух линейных участков, пересечение которых соответствует точке эквивалентности (ктт). Форма кривой зависит от того, какой из компонентов химической реакции титрования является электроактивным, то есть по току какого компонента проводится индикация конечной точки титрования. Основные типы кривых амперометрического титрования с одним индикаторным электродом имеют вид:
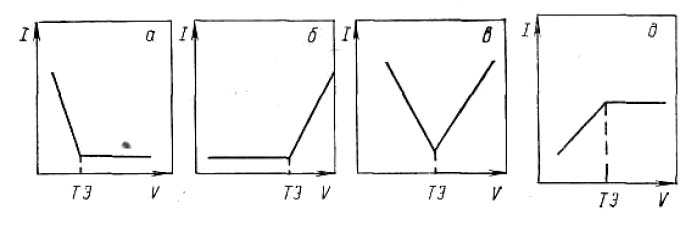
Эти кривые соответствуют случаям, когда электроактивны определяемое вещество (а), титрант (б), определяемое вещество и титрант (в), продукт реакции (д).
Важным моментом является выбор потенциала для титрования, который должен соответствовать предельному току одного или двух участников химической реакции. Для этого необходимо записать полярограммы всех участвующих в реакции титрования веществ и на их основании произвести выбор подходящего потенциала (пример).
Пример.Лекарственный препарат фитин количественно осаждается ионами свинца. На этой реакции основано амперометрическое определение фитина титрованием раствором нитрата свинца. На ртутном капающем электроде на фоне хлорида лития восстанавливаются и фитин (Е1/2 = -1,50 В) и ион свинца (Е1/2 = -0,43 В). Оценить возможность амперометрического титрования фитина раствором нитрата свинца при потенциалах -0,10 В, -0,80 В и -1,70 В. Какую форму имеют кривые титрования при этих потенциалах?
Решение. Предельный диффузионный ток восстановления имеет место при потенциалах более отрицательных, чем потенциал полуволны. Поэтому при потенциале -0,10 В не восстанавливается и, следовательно, не дает ток ни одно из веществ, участвующих в реакции, что делает титрование при этом потенциале невозможным.
При потенциале -0,80 В электроактивным является ион свинца и имеет место диффузионный ток, обусловленный восстановлением этого иона (но не фитина). Поэтому при амперометрическом титровании до точки эквивалентности, пока в растворе отсутствуют ионы Pb2+, ток отсутствует; после точки эквивалентности ток возрастает пропорционально увеличению концентрации ионов свинца, накапливающихся в растворе при добавлении избытка титранта. Кривая амперометрического титрования фитина ионами свинца приЕ = -0,80 В будет иметь вид кривой (б), приведенной на рисунке с типами кривых амперометрического титрования.
При потенциале -1,70 В восстанавливается не только ион свинца, но и фитин, имеющий при этом потенциале предельное значение диффузионного тока. В процессе титрования величина этого тока уменьшается пропорционально уменьшению концентрации фитина и становится практически равной нулю в точке эквивалентности. После точки эквивалентности в растворе появляются избыточные ионы свинца, концентрация которых возрастает по мере добавления титранта, что приводит к возрастанию силы тока. Кривая амперометрического титрования фитина ионами свинца при Е = -1,70 В соответствует кривой (в), приведенной на рисунке с типами кривых амперометрического титрования.
Следует заметить, что в амперометрическом титровании с одним индикаторным электродом применяют как ртутный капающий электрод, используемый в области отрицательных потенциалов (процессы восстановления), так и вращающийся платиновый микроэлектрод, позволяющий работать при достаточно больших положительных значениях потенциала (процессы окисления).
Амперометрическое титрование с двумя индикаторными электродами. Помимо метода амперометрического титрования с одним индикаторным электродом существует также метод амперометрического титрования с двумя индикаторными электродами. В этом методе применяют два одинакового размера электрода, на которые налагают постоянное напряжение. Поэтому в данном методе, в отличие от обычного амперометрического титрования с одним индикаторным электродом, поляризоваться будут оба электрода, т.е. на обоих электродах (на катоде и на аноде) будут протекать электрохимические процессы, зависящие от находящихся в растворе деполяризаторов и наложенного напряжения. Ток будут возникать тогда, когда на каждом из двух электродов будет достигнуто значение потенциала, необходимое для протекания на нем той или иной электрохимической реакции. Эти обстоятельства следует иметь в виду при интерпретации хода кривых титрования.
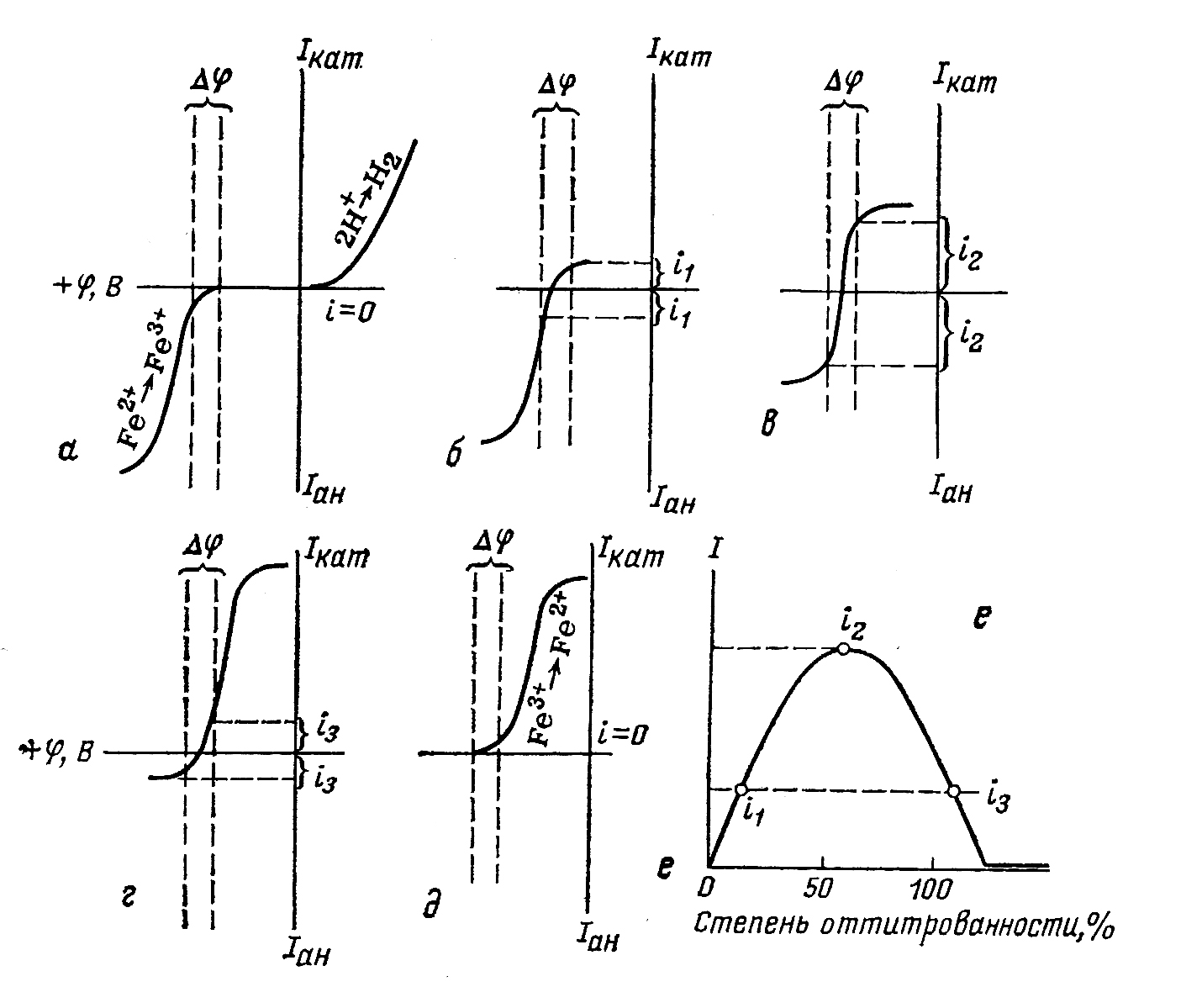
Ход процесса титрования лучше всего проследить, пользуясь вольтамперными кривыми (рисунок)
| Схематические полярограммы для различной степени оттитрованности железа(II) (а,б,в,г,д) окислителем и кривая титрования (е) с двумя индикаторными электродами |
|
Например, если на электроды, погруженные в подкисленный раствор соли Fe(II), не содержащей Fe(III), наложить небольшое постоянное напряжение – около 0,05 В (рис.5.4.3, а, пунктирные линии), то ток в цепи не возникает, так как для протекания электролиза в растворе сульфата железа (II) нужно приложить значительно большее напряжение (напряжение разложения в этом случае составляет примерно 1,0 В). Если же добавить какой-либо окислитель, например, бихромат, то эквивалентное ему количество Fe2+ -ионов будут окислено до Fe3+ -ионов. Система Fe3+/Fe2+ является обратимой системой – это значит, что для осуществления этой электродной реакции достаточно наложить на электроды минимальное напряжение, поскольку потенциал восстановления Fe3+ и анодного окисления Fe2+ практически одинаковы. Следовательно, при напряжении порядка 0,05 В электродный процесс сможет начаться – в цепи появится ток (случай б); на катоде начнется восстановление Fe3+, на аноде – окисление Fe2+. Измерительный прибор зарегистрирует соответствующую силу тока. По мере титрования ток будет возрастать и достигнет максимума при оттитровывании 50 % Fe2+, то есть когда концентрации ионов железа обеих степеней окисления будут равны (случай в). По мере дальнейшего титрования сила тока начнет убывать, так как концентрация Fe2+ будет все время уменьшаться (случай г), и в конечной точке электролиз прекратится вследствие исчезновения этого иона, обеспечивающего анодный процесс при данном напряжении. При дальнейшем добавлении титранта ток остается без изменения. Кривая такого титрования имеет характерный «горб» (случай е). Кривая такой формы получается всегда, когда осуществляется титрование обратимой системы необратимой. Кривые могут иметь и иную форму в зависимости от электрохимической обратимости участников титрования и величин наложенного напряжения:
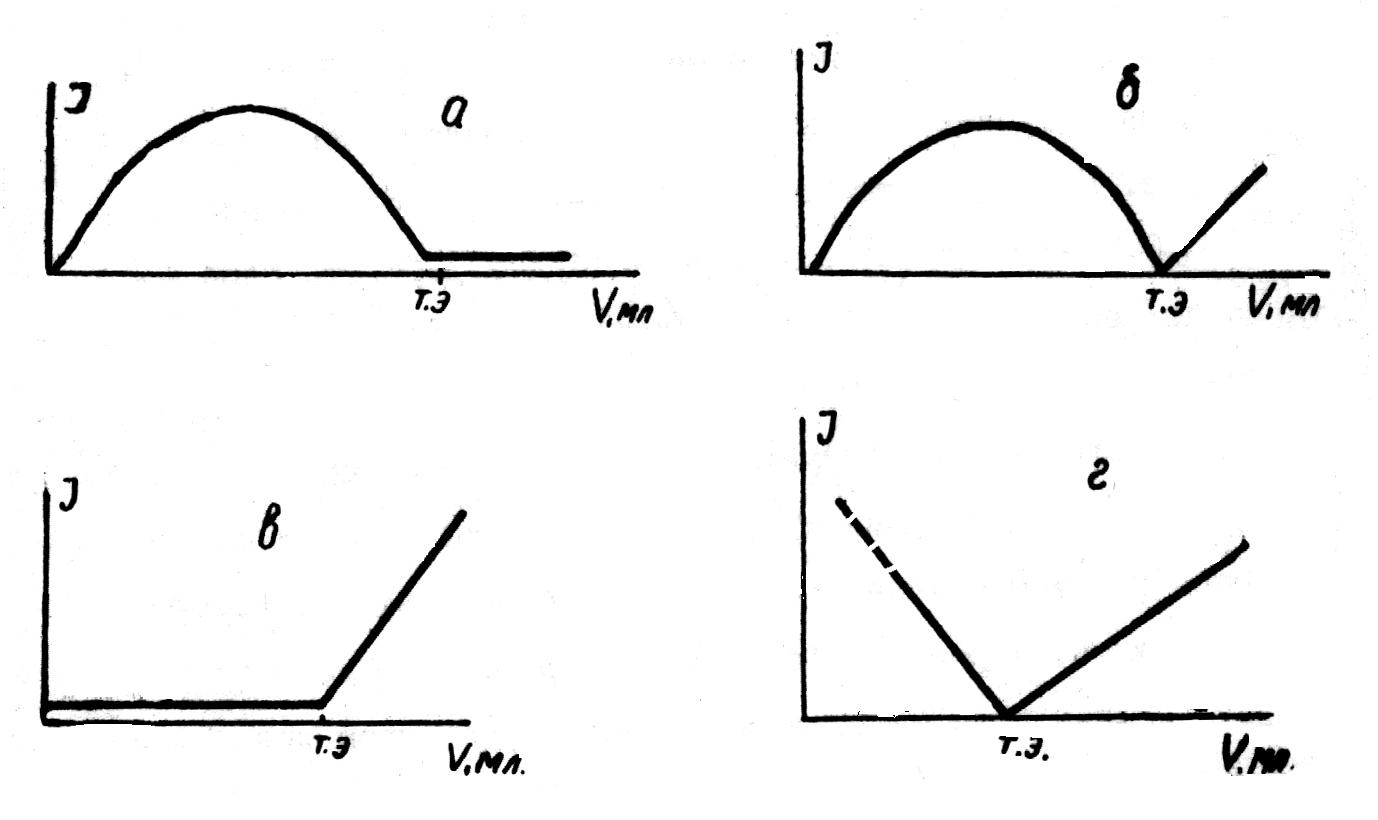
| Формы кривых амперометрического титрования с двумя индикаторными электродами |
|
| а – титрование обратимой системы необратимой; б – титрование обратимой системы обратимой; в – титрование необратимой системы обратимой; г – титрование необратимой системы необратимой |
Метод амперометрического титрования с одним и двумя индикаторными электродами прост в аппаратурном оформлении и легко доступен в эксплуатации. Установки амперометрического титрования могут быть самостоятельно собраны в любой аналитической лаборатории. Схемы установок приведены на рисунках.
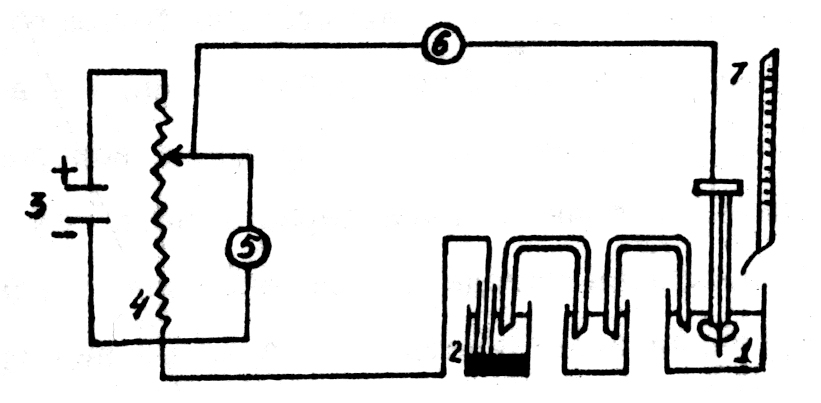
| Схема амперометрической установки с одним индикаторным электродом |
|
| 1 – индикаторный электрод; 2 – электрод сравнения; 3 – аккумулятор; 4 – реостат; 5 – вольтметр; 6 – гальванометр; 7 – микробюретка |
| Схема амперометрической установки с двумя индикаторными электродами |

|
| 1 – источник напряжения; 2 – реостат; 3 – вольтметр; 4 – гальванометр; 5 – платиновые электроды; 6 – мешалка |
Метод амперометрического титрования более универсален, чем полярография и вольтамперометрия, так как определяемое вещество не обязательно должно быть электроактивным (таблица).
Таблица - Примеры практического применения амперометрического титрования
| Определяемый элемент | Титрант | Тип реакции | Среда | Определяемый минимум | |
| мкг/мл | М | ||||
| Cu | Na2S2O3 (тиосульфатом титруют иод, выделяющийся при взаимодействии CucKI | окисление- восстановление | 0,5 М H2SO4 | 1,6.10-5 | |
| Ag | KI | осаждение | 0,05 МH2SO4 | 0,05 | 4,6.10-7 |
| Au(III) | FeSO4 | окисление- восстановление | 0,1 M NaNO3 | 2.10-5 | |
| Zn | K4[Fe(CN)6] | осаждение | ацетатная, рН 5-6 | 0,5 | 7,7.10-6 |
| Hg(II) | KI | осаждение | 0,1-1 М H2SO4 | 5.10-6 | |
| V(IV) | KMnO4 | окисление- восстановление | 2-4 М H2SO4 | 2,4.10-4 | |
| V(V) | K4[Fe(CN)6] | окисление- восстановление | 1 М H2SO4 | 3,9.10-5 | |
| As(III) | I2 | -“- | бикарбонатная, рН 8-9 | 0,5 | 6,7.10-6 |
| As(V) | KI | -“- | 6 M H2SO4 | 2,7.10-5 | |
| Sb(III) | I2 | -“- | бикарбонатная, рН 8-9 | 8,1.10-6 | |
| Se(IV) | 8-меркапто-хинолин | -“- | 1 M H2SO4 | 1,3.10-5 | |
| KI | -“- | 5-10 MHCl | 1,3.10-5 | ||
| Te(IV) | 8-меркапто-хинолин | -“- | 1 M H2SO4 | 7,8.10-6 | |
| Cl- | AgNO3 | осаждение | 0,1 М H2SO4 | 1,1.10-4 | |
| I- | AgNO3 | осаждение | 0,1 М H2SO4 | 1,6.10-5 |
Дата добавления: 2015-11-26; просмотров: 3702;
