ОПРЕДЕЛЕНИЕ МАССЫ МОЛЕКУЛЫ ЭФИРА
Молекулярно-кинетическая теория (МКТ) основывается на трех основных положениях:
1) всякое вещество состоит из частиц – атомов, молекул, ионов;
2) атомы, молекулы и ионы находятся в непрерывном хаотическом движении;
3) между частицами существуют силы взаимодействия – притяжения и отталкивания.
С точки зрения молекулярно-кинетической теории, давление – это средняя величина, результат большого числа соударений молекул об стенку сосуда. Такие средние величины, как давление, температура характеризуют движение и взаимодействие огромной совокупности частиц.
Создателем МКТ газов считается австрийский ученый Людвиг Больцман (1844–1906). Он ввел в физику представление о том, что макроскопический параметр газа – температура (Т) – является мерой энергии кинетического движения частиц. Легко измеряемая температура дает нам наглядное представление об энергии, с которой движутся невидимые мельчайшие частицы.
P=nkT; 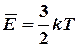
В данных уравнениях постоянная Больцмана k как бы связывает характеристики микромира (средняя кинетическая энергия частиц E) и характеристики макромира (давление газа Р и его температуру Т). Молекула – это наименьшая частица вещества, сохраняющая все его свойства. В данной работе определяется одна из важнейших характеристик молекулы – масса молекулы (m0). Массу молекул нельзя измерить непосредственно, т. к. размеры атомов примерно 10-10 м, а величина массы примерно 10-27 кг.
Описание экспериментальной установки и эксперимента
Экспериментальная установка изображена на рис.1. Стеклянный сосуд закрыт пробкой, через которую проходит стеклянная трубка, с помощью
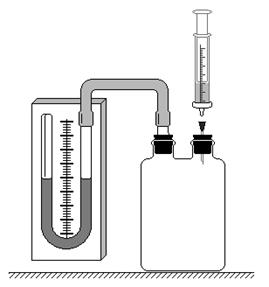 Рис.1
Рис.1
резинового шланга соединенная с жидкостным манометром. Через вторую пробку проходит игла от шприца. С помощью шприца в сосуд вводят некоторое количество эфира, который быстро испаряется, образуя ненасыщенные пары. К ним можно применить законы идеального газа.
Плотность газа по определению находится по формуле:
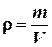 (1)
(1)
где m– масса газа, а V – объем сосуда.
Также плотность газа можно найти, зная массу одной молекулы m0 и количество молекул в единице объема n, т. е. r= m0n (2).
Приравнивая правые части равенств (1) и (2), получим формулу для нахождения массы m0 молекулы эфира:
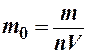 (3)
(3)
Концентрацию (n) молекул можно определить, используя основное уравнение МКТ: Р = nkT, из которого следует:
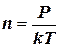 (4)
(4)
где P – парциальное давление газообразного эфира;
k – постоянная Больцмана;
T– абсолютная температура.
Парциальное давление эфира в нашей установке уравновешивается давлением столбика жидкости h в манометрической трубке, т. е.:
P =rвg h,
где rв – плотность жидкости (воды) в манометре;
g – ускорение свободного падения;
h – разность уровней в манометре.
Тогда формулу (4) можно записать в виде:
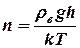 (5)
(5)
Выразив массу паров эфира через плотность и объем введенного в сосуд жидкого эфира, из формулы (4) и (5) определяют массу одной молекулы:
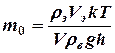 (6)
(6)
(Нужно иметь в виду, что массы молекул жидкого и газообразного эфира равны).
Дата добавления: 2015-10-21; просмотров: 1591;
