Процесс пищеварения и всасывание белков
Белки являются основными функциональными молекулами всех видов живых организмов. Почти любая работа в клетке – химическая, сократительная, рецепторная, транспортная, иммунная и многие другие выполняются белками. В отличие от углеводов и липидов белки и составляющие их аминокислоты не способны резервироваться в организме.
Основным пластическим материалом, служащим для обновления тканевых белков, являются белки пищи. При этом поступающие с пищей белки выполняют три основные функции. Во-первых, они служат источником незаменимых и заменимых аминокислот, которые используются в качестве строительных блоков в ходе биосинтеза белка не только у новорожденных и детей, но и у взрослых, обеспечивая постоянное возобновление и круговорот биополимеров. Во-вторых, аминокислоты белков служат предшественниками гормонов, порфиринов, азотистых оснований и многих других соединений. И, в-третьих, окисление углеродного скелета аминокислот вносит, хотя и небольшой, но важный вклад в ежедневный суммарный расход энергии. В норме белок удовлетворяет потребностям организма в азоте и 20 аминокислотах. Для взрослого человека необходимы 8 незаменимых аминокислот: изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин. Аргинин и гистидин являются незаменимыми аминокислотами для детей, в организме взрослого человека они могут образоваться в различных клетках, особенно в печени. Цистеин и тирозин могут синтезироваться из незаменимых аминокислот метионина и фенилаланина соответственно, однако при недостатке в пище этих аминокислот цистеин и тирозин также становятся незаменимыми. И, наоборот, если цистеин и тирозин находятся в рационе в адекватных количествах, они снижают потребность в метионине и фенилаланине. Остальные 8 аминокислот могут образоваться в организме человека с участием реакций трансаминирования.
Белки значительно отличаются по аминокислотному составу. Некоторые из них содержат полный набор незаменимых аминокислот в оптимальных соотношениях; другие могут не содержать одной или нескольких незаменимых аминокислот. Кроме того, растительные белки, особенно белки пшеницы и других злаков, не могут полностью перевариваться, так как белковая часть зерен защищена состоящей из целлюлозы и других полисахаридов оболочкой, которая не гидролизуется пищеварительными ферментами. Из этого следует, что качество белка и его пищевая ценность определяется соотношением доли незаменимых аминокислот и величины этого показателя при адекватном питании, а также способностью расщепляться в ЖКТ человека. Так, белки яйца и молока обладают высокой ценностью, они эффективно используются организмом и применяются в качестве стандарта при оценке качества других белков. Высококачественный белок содержится в мясе, а многие растительные белки характеризуются относительным дефицитом некоторых незаменимых аминокислот, например, триптофана и лизина (кукуруза), лизина (пшеница), и метионина (некоторые бобовые). Каждый из этих белков обладает низкой питательной ценностью, однако в совокупности они образуют белковую смесь, эквивалентную по питательной ценности белкам молока. Кроме того, богатые соединительными тканями мясные субпродукты (хрящи, фасции, связки и др.), содержащие значительные количества коллагена и эластина, при переваривании образуют ди- и трипептиды, называемые глипролинами и имеющие состав про-гли, гли-про, про-гли-про. Глипролины устойчивы к действию протеаз, поэтому некоторые их количества в неизмененном виде проникают в кровь, где они влияют на процессы свертывания крови, препятствуя тромбообра-зованию, а также повышают устойчивость слизистой оболочки желудка, предотвращая язвообразование. Поэтому белковая пища должна содержать некоторое количество мясных продуктов из соединительных тканей.
Важным фундаментальным и практическим инструментом для оценки правильности режима питания (для здорового человека) в отношении состава пищевых белков является измерение соотношения между количеством вводимого и выводимого из организма азота, называемого азотистым балансом. Равенство между ними – азотистое равновесие (или нулевой азотистый баланс) – свидетельство правильного белкового питания. Преобладание выводимого из организма азота - отрицательный азотистый баланс – наблюдается при белковом голодании (даже при исключении отдельных незаменимых аминокислот) и ряде истощающих заболеваний. Отрицательный азотистый баланс возможен и при таких вариантах голодания, когда аминокислоты организма используются не для ресинтеза белков, а как дополнительный источник энергии. Положительный азотистый баланс (преобладание вводимых в организм белков) наблюдается в период роста организма и при выздоровлении от истощающих заболеваний, когда интенсивный синтез белков преобладает над процессами их распада.
Для поддержания азотистого равновесия достаточно употреблять 30-50 г белка в сутки. Однако такое количество не обеспечивает сохранения работоспособности и здоровья человека. Принятые нормы белкового питания для взрослых и детей учитывают условия труда, климатические условия и другие факторы. Потребность белка для взрослых составляет в среднем 80-100 г в день, а при тяжелой физической нагрузке эта норма увеличивается до 130-150 г. Детям до 12 лет достаточно 50-70 г в сутки, однако для новорожденных потребность в белке гораздо выше (около 2 г/кг массы тела). Количество потребляемого в сутки белка может изменяться при патологических состояниях. Так при хронической недостаточности почек и печени суточное потребление белков падает до 20-40 г, в то время как в период выздоровления после тяжелых инфекций, общих хирургических вмешательств и травм, приеме кортикостероидных и анаболических гормонов потребность в белке увеличивается до 110-120 г в день.
К основным проявлениям патологических процессов, возникающих в условиях неполноценного белкового питания, являются гиподинамия, анемия, дисфункция печени и почек и др. Особенно тяжелы они у детей. Прекращение питания грудным молоком и переход на растительную пищу ведет к задержке роста, физического и умственного развития. Подавление образования пищеварительных ферментов еще больше усиливает проявления белковой недостаточности. Болезнь в целом (так называемый квашиоркор) прогрессирует, нередко приводя к гибели ребенка. У взрослых белковое голодание, проявляясь вначале в отношении физической и психической активности, ведет далее к ряду характерных изменений. Снижение уровня белков, особенно альбуминов плазмы крови, имеет следствием нарушение коллоидно-осмотического равновесия, возникают «голодные отеки». Синтез белков нарушается во многих тканях, в том числе мышечных, что выражается в парезах и параличах периферических мышц и ослаблении сердечной деятельности (миокардиодистрофии). Меняется бактериальная флора кишечника, что в сочетании с нарушениями водного баланса ведет к голодным поносам. Неполноценное белковое питание провоцирует ослабление синтеза иммуноглобулинов и иммунной системы организма, в результате чего учащаются и углубляются инфекционные заболевания.
Вреден и избыток белка в питании, ведущий к перегрузке печени и почек продуктами его распада, перенапряжению секреторной функции пищеварительного аппарата, усилению гнилостных процессов в кишечнике, накоплению в организме продуктов азотистого обмена со сдвигом кислотно-основного состояния в кислую сторону.
Поскольку белки всех организмов отличаются строгой видовой и тканевой специфичностью, живой организм обладает способностью использовать белки только после их полного гидролиза до аминокислот, из которых образуются специфические белки. Поэтому белки, поступающие с пищей, перевариваются до составляющих их аминокислот в желудочно-кишечном тракте человека и животных под действием ряда протеолитических ферментов, образуемых в слизистой оболочке желудка, поджелудочной железы и тонкого кишечника в неактивной форме (проферментов или зимогенов). Такая форма ферментов предотвращает самопереваривание белков в клетках, где они синтезируются. Активация зимогенов происходит в просвете того отдела желудочно-кишечного тракта, куда вырабатывающие их клетки выделяют свои секреты.
Переваривание белков (протеолиз) начинается в желудке и заканчивается в тонком кишечнике. Желудочный сок обладает протеолитической активностью в широком диапозоне рН с оптимумом действия при рН 1,5-2,0 и 3,2-4,0. Основными протеолитическими ферментами желудочного сока человека являются эндопептидазы (ферменты, гидролизующие внутренние пептидные связи): пепсин, гастриксин (пепсин С) и реннин (пепсин D), которые очень близки по строению, что указывает на образование их из общего предшественника. Различие между этими протеазами заключается в оптимуме рН их действия. Так, пепсин имеет максимальную активность при рН 1,5-2,5, тогда как оптимум рН действия гастриксина составляет 3,2-3,5. Соотношение пепсин/гастриксин в желудочном соке взрослого человека составляет 4:1 – 3:1. Присутствие в желудке двух протеиназ, из которых пепсин действует в сильнокислой среде, а гастриксин в среднекислой, позволяет организму человека легче приспосабливаться к особенностям питания. Например, растительно-молочное питание частично нейтрализует кислую среду желудочного сока, и рН благоприятствует переваривающему действию гастриксина. Напротив, мясная пища сдвигает рН желудочного сока в более кислую сторону, что создает оптимальные условия для работы пепсина.
У детей грудного возраста в желудке секретируется фермент реннин (химозин), вызывающий створаживание молока. Реннин катализирует отщепление от основного белка грудного молока казеина гликопептида, в результате чего образуется параказеин. Связывая ионы Са2+, параказеин образует нерастворимый сгусток, чем предотвращает быстрый выход молока из желудка. Параказеин затем подвергается гидролитическому действию пепсина. В желудке взрослых реннина нет, створаживание молока у них происходит с участием соляной кислоты и пепсина.
Пепсин выделяется главными клетками слизистой оболочки желудка в форме пепсиногена и активизируется соляной кислотой, которая секретируется в просвет желудка обкладочными клетками. Соляная кислота в желудке выполняет следующие функции: 1) осуществляет активацию пепсиногена; 2) создает оптимум рН для действия пепсина и гастриксина; 3) денатурирует белки пищи, что увеличивает площадь их поверхности и, тем самым, облегчает гидролиз; 5) обладает бактерицидным действием. Субстратом пепсина являются либо нативные, либо денатурированные белки. Последние легче подвергаются гидролизу. Денатурацию белков пищи обеспечивают кулинарная обработка или действие соляной кислоты. В результате воздействия пепсина на белки последние распадаются до смеси полипептидов, называемых также альбумозами или пептонами. Глубина переваривания белков в желудке зависит от длительности нахождения в нем пищи. Обычно это небольшой период, поэтому основная масса белков расщепляется в кишечнике.
При гипоацидных состояниях (снижении секреции HCl), отсутствии выработки желудочного сока (ахилии) или тотальной резекции желудка желудочный этап переваривания белков сильно замедляется или отсутствует. Без соляной кислоты нарушается набухание белков, активация пепсиногена и снижается (или отсутствует) ферментативная активность пепсина. Из-за множественности протеолитических ферментов, даже при полном отсутствии желудочного пищеварения, прекращения переваривания белков не отмечается, если нет сопутствующей панкреатической недостаточности. Однако при этом сильно изменяется скорость протеолиза и запаздывает появление в свободном виде ряда аминокислот (триптофана, тирозина).
Дальнейшее переваривание высокомолекулярных пептидов и белков, не расщепленных пепсином, осуществляется в тонком кишечнике (рис. 31). Пищеварение в этом отделе начинается в полости кишки (полостное пищеварение), а затем продолжается в зоне слизистой кишечника (пристеночное пищеварение). Белки в этом отделе желудочно-кишечного тракта расщепляют протеолитические ферменты, которые по механизму гидролиза разделяют на две группы: эндопептидазы (трипсин, химотрипсин, эластаза) расщепляют внутренние пептидные связи белков, образуя пептиды; экзопептидазы (карбоксипептидаза А и В, амино-пептидазы, дипептидазы) расщепляют в пептидах и белках концевые связи, освобождая аминокислоты одну за другой. Эндопептидазы и карбоксипептидазы секретируются в кишечник из поджелудочной железы в виде проферментов (зимогенов) – трипсиногена, химотрипсиногена, проэластазы и прокарбоксипептида-зы. Активирование этих ферментов происходит в 12-перстной кишке путем частичного протеолиза. Ключевым процессом активирования всех проферментов является образование трипсина. Превращение трипсиногена в трипсин происходит под действием фермента, вырабатываемого в клетках слизистой оболочки кишечника - энтеропептидазы (энтерокиназы), а затем аутокаталитически и сводится к отщеплению N-концевого гексапептида, называемого ингибитором трипсина. Далее трипсин, разрывая пептидные связи в остальных проферментах, образует активные формы химотрипсина, эластазы и карбоксипептидазы. В кишечном соке присутствуют также аминопептидазы (аланин- и лейцинаминопептидазы) и дипептидазы, объединенные общим названием – эрипсины. Все перечисленные ферменты отличаются друг от друга по субстратной специфичности, которая оп-ределяется структурой радикалов аминокислотных остатков, образующих гидро-лизуемую пептидную связь, и положением связи в полипептиде (табл.).
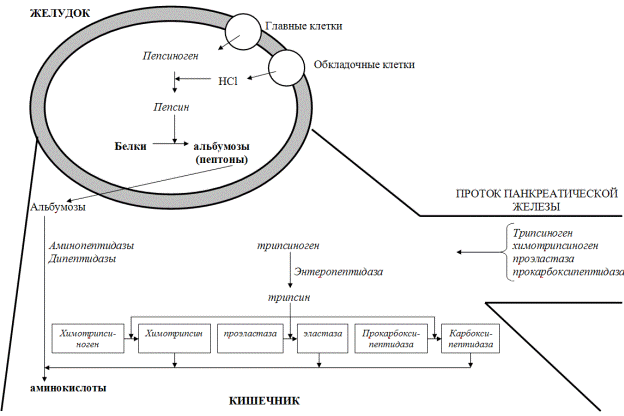
Рис. Переваривание пищевых белков в ЖКТ
Таблица
| Специфичность действия протеаз, фермент | Место образования | Специфичность действия |
| Пепсин | Желудок | Гидролизует пептидные связи, образованные NH2-группой фенилаланина, тирозина, триптофана |
| Гастриксин | Желудок | Гидролизует пептидные связи, образованные дикарбоновыми аминокислотами |
| Трипсин | Поджелудочная железа | Гидролизует пептидные связи, образованные СООН-группой лизина, аргинина |
| Химотрипсин | Поджелудочная железа | Гидролизует пептидные связи, образованные СООН-группой фенилаланина, тирозина, триптофана |
| Эластаза | Поджелудочная железа | Гидролизует пептидные связи, образованные глицином, аланином и серином |
| Карбоксипептидаза А | Поджелудочная железа | Гидролизует пептидные связи, образованные С-концевыми фенилаланином, тирозином, триптофаном |
| Карбоксипептидаза В | Поджелудочная железа | Гидролизует пептидные связи, образованные С-концевыми лизином и аргинином |
| Аланинаминопептидаза | Кишечник | Гидролизует пептидные связи, образованные N-концевым аланином |
| Лейцинаминопептидаза | Кишечник | Гидролизует пептидные связи, образованные N-концевыми аминокислотами |
| Дипептидазы | Кишечник | Гидролизуют пептидные связи в дипептидах |
При каталитическом участии эндопептидаз (трипсина, химотрипсина и эластазы) белки и пептиды расщепляются, образуя смесь коротких пептидов (полостное пищеварение). На завершающем этапе экзопептидазы щеточной каймы и гликокаликса энтероцитов (амино-, дипептидазы) и адсорбированные панкреатические карбоксипептидазы расщепляют эти пептиды до аминокислот (пристеночное пищеварение). Следует отметить, что значительное торможение полостного этапа кишечного пищеварения не компенсируется и дает симптомы креатореи (присутствия в кале непереваренных или полупереваренных мышечных волокон). Наиболее частые причины креатореи – панкреатическая недостаточность (панкреатиты, муковисцидоз, рак).
Вследствие огромной важности белка в питании, при ряде состояний организма, когда не возможен нормальный процесс пищеварения, можно обеспечить питание организма путем введения стерильных растворов аминокислот непосредственно в кровь, т. е. проводят парентеральное питание.
Процесс переваривания белков регулируется системой гормоноподобных соединений, образующихся в клетках пищеварительного тракта. Такими соединениями являются гистамин, гастрин и продуцируемые клетками тонкого кишечника энтерогастрон, секретин и панкреозимин. При поступлении пищи в желудок клетки слизистой желудка секретируют гистамин и гастрин, которые стимулируют секрецию HCl (гастрины также стимулируют продукцию главными клетками слизистой желудка пепсиногена), а энтерогастрон, вырабатываемый клетками
слизистой 12-перстной кишки, тормозит этот процесс.
Переход желудочного содержимого в кишечник способствует выделению регуляторов, продуцируемых клетками тонкого кишечника, которые обеспечивают быстрое выделение панкреатического и кишечного соков. При этом секретин стимулирует секрецию панкреатического сока, богатого водой и бикарбонатами, необходимыми для нейтрализация соляной кислоты, поступившей из желудка с пищевым комком (в результате рН резко возрастает до 7,2-7,8). Выработка секретина, в свою очередь, увеличивается при закислении содержимого тонкого кишечника. Поступление аминокислот в двенадцатиперстную кишку вызывает высвобождение гормона панкреозимина (холецистокинина), который стимулирует секрецию ферментов панкреатического сока, а также желчи.
Всасывание аминокислот, образовавшихся при переваривании белков, осуществляется эндотелиальными клетками слизистой оболочки тонкого кишечника. Транспорт аминокислот через клеточные мембраны осуществляется в основном по механизму вторично-активного транспорта. Известен ряд сходных по строе-нию переносчиков (транслоказ), специфичных к транспорту аминокислот: ней-тральных алифатических, нейтральных циклических, кислых, основных аминокислот и пролина. Эти системы, связывая ионы Na+, индуцируют переход белка-переносчика в состояние с резко увеличенным сродством к соответствующей аминокислоте. Na+ по градиенту концентрации стремится в клетку и одновремен-но переносит внутрь клетки молекулу аминокислоты. Энергия АТФ затрачивается Na+,К+-зависимой АТФ-азой на выкачивание ионов натрия из клетки, создания электрохимического градиента на мембране, энергия которого опосредованно обеспечивает транспорт аминокислот в клетку. Чем выше градиент ионов Na+, тем выше скорость всасывания аминокислот, которые конкурируют друг с другом за соответствующие участки связывания в транслоказе. Существует также специальная γ-глутамилтрансферазная система транспорта всех аминокислот в клетку, кофактором которой служит глутатион.
В кишечнике возможно всасывание небольших количеств ди- и трипептидов. Всасываются они путем пиноцитоза и внутри клетки гидролизуются протеиназами лизосом. У новорожденных вследствие низкой протеолитической актив-ности ферментов пищеварительных соков и высокой проницаемости мембран клеток слизистой оболочки кишечника возможно всасывание нативных белковых молекул и их фрагментов, что может вызвать повышенную чувствительность (сенсибилизацию) к ним организма и явиться причиной пищевой аллергии. Следует также заметить, что всасывание нерасщепленных антител из молока матери является важным механизмом защиты новорожденных от инфекционных заболеваний.
Дата добавления: 2015-10-19; просмотров: 1787;
