Факторы устойчивости коллоидных систем
Все дисперсные системы с точки зрения термодинамики неустойчивы. Однако они могут существовать достаточно длительное время, благодаря двум факторам:
1. Агрегативный фактор устойчивости связан с одноименным зарядом гранул коллоидных частиц, который противодействует слипанию и укрупнению частиц при столкновении друг с другом.
2. Кинетический фактор устойчивости связан со способностью частиц дисперсной фазы к самостоятельному тепловому движению в растворе, т.е. к броуновскому движению. Она тем больше, чем меньше частицы и вязкость дисперсной системы.
Кинетическая устойчивость теряется после того, как нарушена агрегативная устойчивость. Золь, лишенный агрегативной устойчивости, коагулирует,т.е. частицы слипаются в более крупные агрегаты, которые выпадают в осадок из коллоидного раствора. Система становится агрегативнои кинетически неустойчивой. Для большинства лиофобных золей процесс коагуляции является необратимым, лиофильные же золи могут быть снова переведены из осадка в коллоидное состояние — этот процесс называется пептизацией.
Процесс укрупнения, слипания коллоидных частиц с образованием более крупных агрегатов называют коагуляцией. Коагуляцию коллоидных систем можно вызвать либо физическими методами (нагреванием или тщательным перемешиванием), либо химическими (введение сильного электролита или другого коллоидного раствора, имеющего противоположно заряженную гранулу).
В случае добавления электролита, коагуляцию вызывают те ионы, которые имеют заряд, по знаку противоположный заряду гранулы, такие ионы называются коагурирующими; чем выше заряд таких ионов, тем большим коагулирующим эффектом они обладают. Например, коагуляцию положительно заряженных частиц золя гидроксида железа (III) можно вызвать анионами 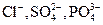 . При этом, чтобы получить одинаковый эффект коагуляции, однозарядных анионов
. При этом, чтобы получить одинаковый эффект коагуляции, однозарядных анионов 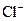 нужно прибавить больше, чем двухзарядных ионов
нужно прибавить больше, чем двухзарядных ионов 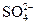 , а двухзарядных больше, чем трехзарядных анионов
, а двухзарядных больше, чем трехзарядных анионов 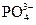 .
.
Минимальная концентрация электролита, вызывающая снижение арегативной устойчивости за определенный промежуток времени называется порогом коагуляции.
Гели кремниевой кислоты
Растворимость SiO2 в воде очень мала, причем основной формой существования кремнезема в растворе является ортокремниевая кислота H4SiO4 или Si(OH)4, в которой кремний координирован четырьмя анионами кислорода, связанными с четырьмя анионами водорода. С течением времени ортокремниевая кислота за счет процесса конденсационной полимеризации переходит из истинного раствора в коллоидный. Полимеризация сопровождается образованием самых разнообразных поликремниевых кислот коллоидной степени дисперсности общего состава mSiO2×nH2O, где m и n могут принимать самые разные значения, например диортокремниевая 2SiO2×3H2O, тетраортокремниевая 4SiO2×5H2O и т.д.
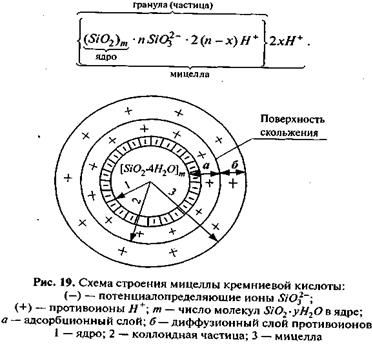
В дальнейшем коллоидные частицы могут агрегироваться, превращаясь из золя в структурированный гель по схеме:
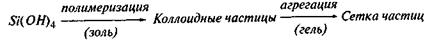
Обезвоживанием этих гелей путем их нагревания можно получить тонкодисперсный безводный порошок SiO2 (так называемый силикагель), обладающий очень высокой удельной поверхностью. Его используют в качестве хорошего адсорбента для осушки и очистки различных материалов, а также в качестве эффективного носителя катализаторов и т.п.
Дата добавления: 2015-10-19; просмотров: 2191;
