Постулаты Бора. Спектр водорода
Более совершенную модель атома предложил Нильс Бор. Он оставил по сути неизменной модель атома Резерфорда, но ввел ряд положений, противоречащих классической физике, которые были названы постулатами Бора.
1. В атоме существуют устойчивые (стационарные) состояния, характеризующиеся определенными значениями энергий Е1 Е2, ... Еn, находясь в которых атом не рождает и не поглощает электромагнитное излучение.
2. При переходе из одного стационарного состояния в другое (самопроизвольно или вынужденно) атом излучает или поглощает порцию (квант) электромагнитной энергии, величина которой равна
|Еn - Em| = hv, (11.1)
где n > m соответствует излучению, n < m ¾ поглощению; h = 6,62 × 10-34 Дж × с называется постоянной Планка; v - частота излучаемой (поглощаемой) электромагнитной энергии.
Произведение Е = hv представляет собой энергию кванта электромагнитного излучения. Энергию кванта можно выразить и через длину волны излучения.
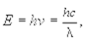 (11.2)
(11.2)
где с ¾ скорость света в вакууме.
Кроме указанных двух утверждений Н. Бор ввел следующее соотношение для кругового движения электрона вокруг ядра атома
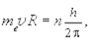 (11.3)
(11.3)
где mе ¾ масса электрона, v ¾ его скорость, R ¾ радиус орбиты электрона при его вращении вокруг ядра атома, когда он находится в одном из стационарных состояний, h ¾ постоянная Планка, n ¾ целое число (1, 2, 3...).
Теория Бора позволяет определить энергию и радиус вращения электрона вокруг ядра водородоподобного атома (рассматривается конкретный электрон без учета остальных) для различных стационарных состояний:
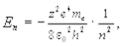 (11.4)
(11.4)
где z ¾ атомный номер элемента.
Стационарное состояние с наименьшей энергией (n = 1) называют основным состоянием атома. Состояния атома с большей энергией (n > 1) носят название возбужденных состояний.
Таким образом, состояния атома характеризуются дискретным набором энергий, т. е. энергия атома квантуется.
Для радиусов вращения электронов в стационарных состояниях можно получить следующее выражение
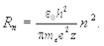 (11.5)
(11.5)
При z = l (атом водорода) и n = 1 получается первый боровский радиус орбиты, наименьший из всех возможных. Подстановка констант в выражение 11.5 дает следующее значение первого боровского радиуса R1 = 5,28 × 10-11 м.
Частоту электромагнитного излучения атома можно подсчитать по формуле
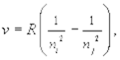 (11.6)
(11.6)
где ni ¾ число, соответствующее стационарному состоянию, в которое переходит атом после излучения; nj ¾ число, соответствующее состоянию атома до излучения; R ¾ постоянная Ридберга (R = 3,29 × 1015 с-1).
По теории Бора линейчатый спектр атома водорода представляет собой спектральные линии, соответствующие переходу атома из различных стационарных состояний с более высокими энергиями (nj) в определенное стационарное состояние с меньшей энергией (ni). Так серия линий, соответствующих в выражении (11.6) ni = 1 (nj = 2, 3...) носит название серии Лаймана в ультрафиолетовой части спектра. Если ni = 2 (nj = 3, 4...), спектральные линии лежат в видимой части спектра и носят название серии Бальмера.
Далее (nj =3) находится серия Пашена в инфракрасной области и т. д. (рис. 11.1).
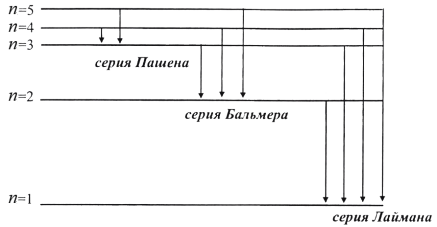
Рис. 11.1
Спектр поглощения атома водорода также является линейчатым, но содержит только серию Лаймана (свободные атомы водорода обычно находятся в состоянии с n = 1).
Исходя из вышесказанного, можно сделать следующие заключения:
1. Свет излучается и поглощается атомами в виде отдельных порций ¾ квантов.
2. Квант электромагнитного излучения можно рассматривать как элементарную частицу (корпускулу) с энергией Е = hv.
Дата добавления: 2015-10-19; просмотров: 1273;
