Виконання роботи. Завдання 1. Вивчення системи мікроскопа
Завдання 1. Вивчення системи мікроскопа
а) Оптична: об’єктив і окуляр. Об’єктив являє собою складну систему лінз, вміщених у металевий футляр. До складу кожного мікроскопа входять декілька об’єктивів, які дають різне збільшення: 8-х, 20-х, 40-х, 60-х, 90-х.
Окуляр порівняно з об’єктивом має простішу будову, він складається тільки з двох лінз і діафрагми, вміщених у металеву оправу зі збільшенням 7-х, 10-х, 15-х. Загальне збільшення мікроскопа вираховують перемножуючи власне збільшення окуляра на власне збільшення об’єктива.
б) Освітлювальна: конденсор, ірисова діафрагма, дзеркало. Конденсор (освітлювач) складається з кількох лінз, вміщених у циліндричну оправу, під конденсором розміщена ірисова діафрагма. Змінюючи діаметр отвору діафрагми і положення конденсора, регулюють яскравість освітлення і чіткість зображення об’єкта. Дзеркало необхідне для направлення променів світла в конденсор. В залежності від яскравості освітлення можна користуватися пласкою або увігнутою поверхнею дзеркала.
в) Механічна. Тубусоутримувач – частина штатива, з’єднана з основою і механізмом для переміщення тубуса. Тубус – циліндр, у верхній отвір якого вставляється окуляр, а на нижньому кінці закріплений револьвер – диск з гніздами для об’єктивів, який обертається. Макрометричний ґвинт призначений для грубого фокусування мікроскопа. Мікроскопічний ґвинт призначений для тонкого фокусування. Предметний столик застосовується для установки досліджуваного препарату. Столик складається із двох частин: нижньої нерухомої, з’єднаної зі штативом, і верхньої – рухомої. Для переміщення верхньої частини столика призначені ґвинти, які розміщені з двох боків столика. Основа мікроскопа (ніжка) надає йому стійкості.
Завдання 2. Засвоїти основні правила роботи з мікроскопом і оволодіти методикою виготовлення тимчасових препаратів
Алгоритм роботи. Мікроскоп установлюється навпроти лівого плеча; справа на столі повинні знаходитися необхідні інструменти, реактиви, альбом для зарисовки об’єктів.
Починаючи роботу, треба домогтися рівномірного та яскравого освітлення поля зору. Для цього, обертаючи револьверну голівку, установлюють об’єктив 8-х, перевіряють відстань до предметного столика (0,8-0,9 см). Повертають вилку із дзеркалом у сторону джерела світла. Якщо джерело світла віддалене, а також при роботі з великим збільшенням, краще застосовувати увігнуту поверхню дзеркала, при штучному освітленні користуються його пласкою стороною. Для правильного освітлення необхідно встановити фронтальну лінзу конденсора на рівні столика мікроскопа, відкрити діафрагму. Для рівномірного освітлення поля зору дзеркало повертають так, щоб пучок променів, який пройшов через об’єктив, яскраво освітлював поле зору. Встановлене освітлювання не повинне порушуватися до кінця роботи з мікроскопом.
На лабораторних заняттях з анатомії рослин частіше використовують тимчасові препарати, які готують на заняттях і після вивчення знищують. Під час виготовлення препарату об’єкт розміщують на предметному склі в краплі якогось середовища: води, лактофенолу, гліцерину, реактиву Люголя. На лівий край краплі ребром прикладають скельце і, підтримуючи його препарувальною голкою, обережно опускають. При різкому опусканні покривного скельця в препараті можуть бути бульбашки повітря, які під мікроскопом мають чорні контури. При необхідності препарат фарбують відповідними реактивами. Виготовлений препарат розміщують на предметному столику, орієнтуючи його навпроти об’єктива. Дивлячись в окуляр лівим оком, за допомогою макрометричного ґвинта необхідно домогтися виникнення зображення об’єкта; робоча відстань між об’єктом і нижньою лінзою об’єктива з восьмикратним збільшенням становить 8-9 мм, з сорокакратним збільшенням – 0,5 мм. Переведення з малого збільшення на велике здійснюють шляхом обертання револьвера доти, доки об’єктив не буде встановлений вертикально відносно столика. Після зміни об’єктива в мікроскопі видно нечітке зображення. Точне фокусування об’єкта проводять за допомогою мікрометричного ґвинта, який рекомендується обертати не більше ніж на півоберта, різкість зображення регулюється за допомогою діафрагми.
Зробити підписи до рисунка 1.1.

| 1 – ______________________________ 2 – ______________________________ 3 – ______________________________ 4 – ______________________________ 5 – ______________________________ 6 – ______________________________ 7 – ______________________________ 8 – ______________________________ ______________________________ 9 – ______________________________ 10 – _____________________________ 11 – _____________________________ |
 Рис. 1.1 – Будова світлового мікроскопа
Рис. 1.1 – Будова світлового мікроскопа
Завдання 3. Вивчити будову рослинної клітини на прикладі опуклої луски цибулі городньої (Allium cepa)
Алгоритм роботи. Приготувати тимчасовий препарат частини опуклої луски цибулі, пофарбувати його розчином Люголя та вивчити при малому і великому збільшеннях мікроскопа.
Встановити: форму клітин (багатокутові, квадратні, округлі і т. ін.), з’єднання клітин між собою (щільне, переривчасте), будову оболонки (суцільна, з порами), розташування ядра (пристінне, центральне), наявність ядерець (одне, декілька, у центрі ядра, на периферії).
Зробити підписи до рисунка 1.2.
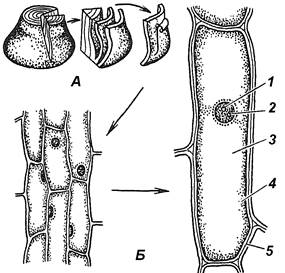
| А – ____________________ ____________________ Б – ___________________ 1 – _____________________ 2 – _____________________ 3 – _____________________ 4 – _____________________ 5 – _____________________ |
 Рис. 1.2 – Будова рослинної клітини на прикладі опуклої луски цибулі городньої
Рис. 1.2 – Будова рослинної клітини на прикладі опуклої луски цибулі городньої
Завдання 4. Вивчити хлоропласти в клітинах листка валіснерії (Vallisneria spiralis) або елодеї (Еllоdea canadensis)
Алгоритм роботи. Приготувати тимчасовий препарат шматочка листка елодеї або валіснерії, розмістивши його в краплі води верхньою стороною до покривного скельця.
Вивчити при малому і великому збільшеннях мікроскопа клітини верхнього епідермісу листка, визначити їх форму і розташування в клітинах хлоропластів. Простежити переміщення хлоропластів, захоплених током цитоплазми, визначити тип руху цитоплазми. При малому збільшенні мікроскопа знайти зубці по краю листка, оболонку, тонкий шар цитоплазми, ядро, пластиди, вакуоль, відмітити форму клітин. Зробити підписи до рисунка 1.3.
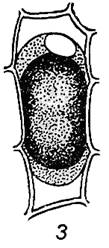
На цей препарат нанести 30% розчин сахарози або 8% розчин NаСІ, попередньо видаливши воду фільтрувальним папером. Простежити за протіканням плазмолізу. Замінити гіпертонічний розчин водою і простежити, як склад клітини повертається в своє первинне положення – явище деплазмолізу. Ознайомитися з формами плазмолізу рослин в залежності від плазмолітика (рисунок 1.4).
| 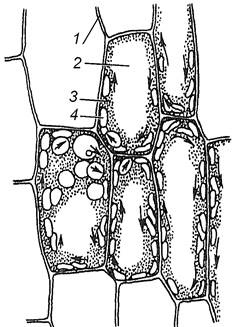
|
1 – ________________________
2 – ________________________
3 – ________________________
4 – ________________________
 Рис. 1.3 – Хлоропласти в клітинах листка елодеї Рис. 1.3 – Хлоропласти в клітинах листка елодеї
|
|
1 – опуклий плазмоліз в 0,5 М розчині сахарози
2 – судорожний плазмоліз в 0,2 М розчині СаСl2
3 – ковпачковий плазмоліз в 0,4 М розчині KCNS
 Рис. 1.4 – Форми плазмолізу рослинних клітин в залежності від плазмолітика Рис. 1.4 – Форми плазмолізу рослинних клітин в залежності від плазмолітика
|
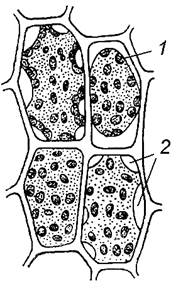
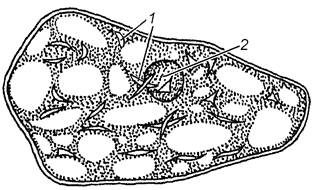
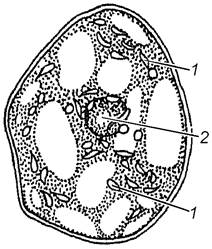
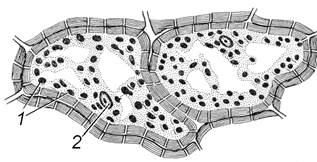
Завдання 5. Вивчити хромопласти у клітинах м’якоті стиглих плодів горобини (Sorbus аисираrіа), шипшини (Rosa сапіпа) або стручкового перцю (Сарsicum аnnum)
Алгоритм роботи. Невеликий шматочок м’якоті плода рівномірно розподілити в краплині води так, щоб клітини не налягали одна на одну. Приготувати тимчасовий препарат.
При малому збільшенні мікроскопа визначити форму клітин.
Вивчити клітини при великому збільшенні мікроскопа. Знайти тонку оболонку, пристінний шар цитоплазми, в який занурене ядро і хромопласти. У клітинах стиглих плодів ядра можуть бути невидимі. Звернути увагу на форму хромопластів, їх забарвлення, розміщення в клітині.
Зробити підписи до рисунка 1.5.
А
| Б
|
В
| 1 – ____________________ 2 – ____________________ |
Рис. 1.5 – Хромопласти у клітинах м’якоті стиглих плодів горобини (А), шипшини (Б) та стручкового перцю (В)
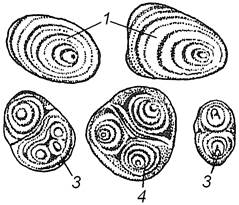
Завдання 6. Вивчити запасний крохмаль у бульбі картоплі (Solanum tuberosum), зернах вівса (Аvena sativa), пшениці (Triticum durum)
Алгоритм роботи. З поверхні зрізу бульби картоплі кінчиком скальпеля зібрати трохи соку і приготувати тимчасовий препарат. Вивчити будову крохмальних зерен, відмітити різноманітність їх розмірів і форми. Зменшуючи освітлення за допомогою діафрагми, визначити розміщення центра крохмалеутворення та звернути увагу на нашарування крохмальних зерен. Нашарування зерен пояснюється різним вмістом води в шарах крохмалю. Шари з більшою кількістю води під мікроскопом мають більш темний вигляд. Дрібні округлі крохмальні зерна мають концентричні шари, великі зерна – ексцентричні. Більшість крохмальних зерен прості, але зустрічаються також складні і напівскладні зерна, які мають по 2-3 центра крохмалеутворення. Складні зерна дрібніші від простих, у них навколо центра наявні шари крохмалю. У напівскладному зерні, крім окремих шарів, наявні загальні для всього зерна крохмальні шари.
При великому збільшенні мікроскопа розглянути прості, складні та напівскладні зерна крохмалю. Провести кольорову реакцію на крохмаль з розчином Люголя, відмітити появу синього забарвлення.
Набрякле зернятко вівса розрізати скальпелем, зібрати зі зрізу трохи ендосперму, рівномірно розподілити його в краплі води і вивчити при великому збільшенні. У вівса крохмальні зерна складні, округло-овальної форми, складаються з великої кількості дрібних багатокутних простих зерен, нашарування зерен непомітне. Складне зерно легко розпадається на окремі прості зерна або їх невеликі групи.
У пшениці крохмальні зерна прості, округлі або овальні, двох типів: великі з концентричним нашаруванням та дрібні – в яких нашарування не видно. Провести мікрохімічну реакцію на крохмаль.
Зробити підписидо рисунка 1.6, вміти розрізняти крохмальні зерна картоплі, пшениці, вівса; прості (концентричні та ексцентричні), складні та напівскладні крохмальні зерна.
А
| Б
|
В
| А ______________________________ Б ______________________________ В ______________________________ 1 – ____________________________ 2 – ____________________________ 3 – ____________________________ 4 – ____________________________ |
 Рис. 1.6 – Крохмальні зерна
Рис. 1.6 – Крохмальні зерна
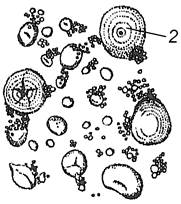
Завдання 7. Вивчити кристалічні включення в клітинах рослин
7.1. Кристали оксалату кальцію в клітинах зовнішньої луски цибулі городньої (Allium сера)
Приготувати тимчасовий препарат шматочка сухої луски цибулі городньої в краплі гліцерину. При малому збільшенні мікроскопа знайти клітини з кристалами, визначити їх форму і місцезнаходження в клітині. При великому збільшенні мікроскопа знайтиклітини з поодинокими або попарноз’єднаними кристалами призматичної форми, розміщеними у вакуолях.
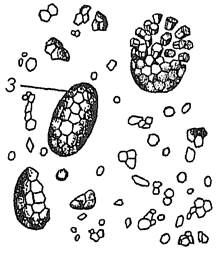
7.2. Друзи в плодах шипшини собачої (Rosa саnіnа) та в клітинах черешка бегонії (Begonia sp.)
Приготувати тимчасовий препарат, для чого невеликий шматок м’якоті плода шипшини розподілити тонким шаром в краплі води. При малому збільшенні мікроскопа знайти клітини з друзами – зростками багаточисленних дрібних кристалів. При великому збільшенні мікроскопа вивчити будову друзи.
Друзи можна роздивитися також в клітинах черешка листка бегонії. Тонкі поперечні зрізи черешка листка бегонії розмістити в краплі води. Клітини черешка бегонії округло-багатокутної форми, тонкостінні з пристінним шаром цитоплазми. У вакуолях клітин кристали щавелевокислого кальцію зустрічаються у вигляді поодиноких ромбоедрів, або у вигляді ромбоедрів, що обростають більш дрібними кристалами.
Зробити підписидо рисунків 1.7 та 1.8.
| 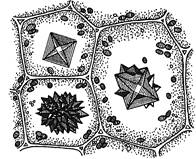
|
| 1 – ______________________________ 2 – ______________________________ Рис. 1.7 – ________________________ __________________________________ | Рис. 1.8 – _____________________ _______________________________ _______________________________ |
7.3. Рафіди в клітинах черешка або стебла винограду (Vitis vinifera)
Тонкий поперечний зріз стебла або черешка винограду розмістити в краплі гліцерину або води, приготувати тимчасовий препарат. При малому збільшенні мікроскопа знайти клітини з пучком голкоподібних кристалів – рафідів. Клітини, які містять рафіди, видовжені. Рафіди в них оточені слизистим чохлом і займають майже всю порожнину клітини. При великому збільшенні мікроскопа розглянути 1-2 клітини, що мають рафіди.
Зробити підписидо рисунка 1.9.
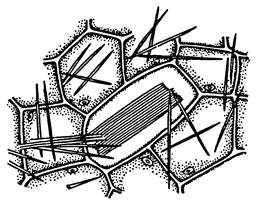
| Рис. 1.9 – _______________________ ________________________________ ________________________________ |
Завдання для самостійної роботи
Завдання 8. Вивчити субмікроскопічну будову рослинної клітини
Алгоритм роботи. Зробити підписи до рисунка 1.10, використовуючи рисунок підручника.
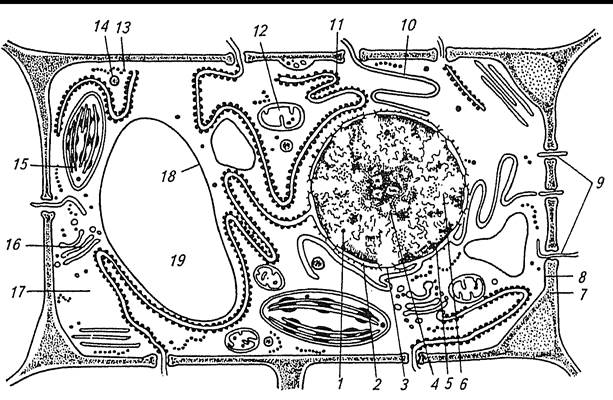
|
| 1 – ____________________________ 2 – ____________________________ 3 – ____________________________ 4 – ____________________________ 5 – ____________________________ 6 – ____________________________ 7 – ____________________________ 8 – ____________________________ 9 – ____________________________ 10 – ____________________________ ____________________________ | 11 – ____________________________ ____________________________ 12 – ____________________________ 13 – ____________________________ 14 – ____________________________ 15 – ____________________________ 16 – ____________________________ ____________________________ 17 – ____________________________ 18 – ____________________________ 19 – ____________________________ |
 Рис. 1.10 – Схема субмікроскопічної будови рослинної клітини
Рис. 1.10 – Схема субмікроскопічної будови рослинної клітини
Завдання 9. Вивчити лейкопласти в клітинах епідерми листка традесканції (Тrаdescantia sp.)
Алгоритм роботи. Зробити біля основи з нижньої частини листка неглибокий надріз, захопити його край і зняти епідерму. Приготувати тимчасовий препарат, розмістивши епідерму в краплі слабкого розчину сахарози.
При малому збільшенні мікроскопа визначити форму клітин.
При великому збільшенні мікроскопа знайти в одній із клітин тяжі цитоплазми і ядро; в цитоплазмі та, особливо, навколо ядра знайти дрібні знебарвлені округлі тільця – лейкопласти, підрахувати їх кількість.
Зробити підписи до рисунка 1.11.
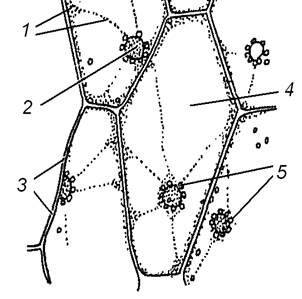
| 1 – __________________________ 2 – __________________________ 3 – __________________________ 4 – __________________________ 5 – __________________________ Кількість лейкопластів ____ |
 Рис. 1.11 – Лейкопласти в клітинах епідерми листка традесканції
Рис. 1.11 – Лейкопласти в клітинах епідерми листка традесканції
Завдання 10. Вивчити сферокристали інуліну в клітинах кореневої бульби жоржини (Dahlia pinnata) або топінамбура (Helianthus tuberosus)
Алгоритм роботи. Зробити 2-3 тонких поздовжніх або поперечних зрізи через бульбу, найтонший розмістити в краплі гліцерину або спирту, накрити покривним скельцем. При малому збільшенні мікроскопа знайти на препараті сферокристали, що являють собою сукупність голчастих кристалів і розходяться від кутів клітини у вигляді променів. Інколи у сферокристалах видно концентричні шари і радіальні тріщини. У кожній клітині може бути декілька сферокристалів.
Зафарбувати препарат 20% розчином α-нафтолу при підкисленні 20% розчином сірчаної кислоти (реакція Моліша). Поява малинового забарвлення свідчить про наявність інуліну, при обробці препарату спиртом, сферокристали інуліну мають сірий колір.
Зробити підписи до рисунка 1.12.
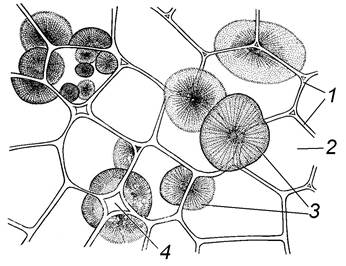
|
1 – __________________________
2 – __________________________
3 – __________________________
4 – __________________________
 Рис. 1.12 – Сферокристали інуліну в клітинах кореневої бульби топінамбура Рис. 1.12 – Сферокристали інуліну в клітинах кореневої бульби топінамбура
|
Завдання 11. Вивчити запасні білки і жирні олії в насінні рицини (Ricinus communis)
Алгоритм роботи. Очищений від шкірочки шматок насінини рицини рівномірно розподілити на предметному склі в краплі розчину Люголя, змішаного із розчином сахарози, щоб зупинити утворення емульсії жиру і набрякання алейронових зерен. Вивчити його при великому збільшенні мікроскопа. Знайти овальні або грушовидні складні алейронові зерна, які складаються з 1-2 забарвлених у золотисто-бурий колір кристалоїдів і 1-2 знебарвлених кульок – глобоїдів. Кристалоїди і глобоїди оточені білковою масою.
На сухе предметне скло нанести невелику кількість м’якоті насіння рицини, видавити з неї скальпелем краплі олії та зафарбувати цей мазок реактивом Судан-ІІІ. Судан-ІІІ активно вбирається жирною олією, від чого її краплі забарвлюються в оранжево-червоний колір. Вивчити при малому збільшенні мікроскопа окремі краплі жирної олії.
Зробити підписи до рисунка 1.13.
А 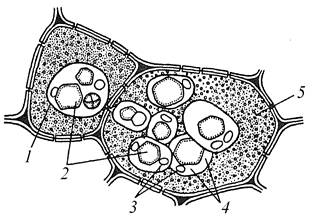
| Б
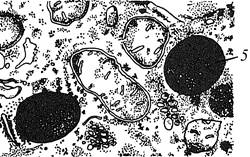
|
| 1 – ____________________________ 2 – ____________________________ 3 – ____________________________ | 4 – __________________________ 5 – __________________________ |
 Рис. 1.13 – Складні алейронові зерна (А) в клітинах ендосперму насіння рицини та краплі жирної олії (Б)
Рис. 1.13 – Складні алейронові зерна (А) в клітинах ендосперму насіння рицини та краплі жирної олії (Б)
Завдання 12. Вивчити кристалічні включення в клітинах рослин
12.1. Кристали карбонату кальцію в листках фікуса (Ficus elastica)
Зробити тонкий поперечний зріз листка фікуса. У великих клітинах гіподерми, що межують з мезофілом верхньої сторони листка, знайти цистоліт – гроноподібне накопичення кристалів. Упевнитися в тому, що він складається із вапняку. Для цього з боку покривного скельця нанести краплю сірчаної кислоти (25%). Під дією кислоти цистоліт розчиняється з виділенням повітряних кульок.
Зробити підписидо рисунка 1.14.
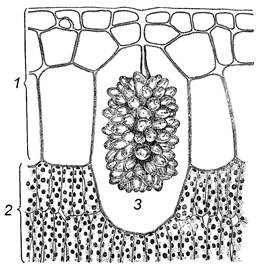
| 1 – ____________________________ 2 – ____________________________ 3 – ____________________________ Рис. 1.14 – Частина поперечного розрізу листка фікуса |
12.2. Кристалічний пісок в клітинах листка белладонни (Atropa belladonna)
| Шматочки сухого листка белладонни прокип’ятити у 5-% спиртовому розчині лугу. Це дозволяє зробити рослинний матеріал м’якішим та прозорішим. Приготувати тимчасовий препарат: шматочки листка розмістити на предметному скельці в краплі хлоралгідрату, накрити покривним скельцем та вивчити препарат при малому збільшенні мікроскопа. Знайти клітину з кристалічним піском (рисунок1.15). | 
| |
| Рис. 1.15 – Клітина листка белладонни з кристалічним піском |
Питання для самоконтролю
1. Як визначити збільшення мікроскопа?
2. Чому дорівнює робоча відстань мікроскопа при малому (8-х) і великому (40-х) збільшеннях?
3. Як перейти від малого до великого збільшення мікроскопа?
4. За яких умов, для якої мети і як використовують мікрометричний ґвинт?
5. В якому положенні слід залишати мікроскоп після закінчення роботи?
6. Як приготувати тимчасовий препарат?
7. Чому не можна розглядати об’єкт під мікроскопом в повітряному середовищі?
8. Чим відрізняється тимчасовий препарат від постійного?
9. Які частини клітини можна розглядати в оптичному мікроскопі?
10. Де в клітинах знаходиться ядро?
11. Яка форма хлоропластів, де вони розміщуються в клітинах?
12. Які пігменти забарвлюють хлоропласти і яка їх роль?
13. В яких органах рослин найчастіше зустрічаються хромопласти?
14. Які пігменти наявні у хромопластах?
15. Чим зумовлена форма хромопластів?
16. Де розміщені в клітинах лейкопласти, їх форма і значення?
17. У чому відмінність між обертальним та струменястим рухами цитоплазми?
18. Як називається напружений стан оболонки клітини?
19. Які причини зумовлюють плазмоліз і деплазмоліз в клітинах?
20. У чому різниця між первинним і вторинним крохмалем?
21. Яка різниця між простими, складними і напівскладними крохмальними зернами?
22. Чим зумовлене нашарування крохмальних зерен?
23. Чим відрізняються крохмальні зерна вівса від крохмальних зерен картоплі?
24. Чи можна за формою крохмального зерна визначити, до якого виду рослин воно належить?
25. У чому відмінність простих алейронових зерен від складних?
26. За допомогою яких реактивів і барвників можна виявити в клітинах запасні речовини: крохмаль, білки, жирні олії, інулін?
27. Із яких за формою кристалів утворені рафіди, друзи?
28. Яку форму мають поодинокі кристали?
Дата добавления: 2015-09-07; просмотров: 8233;
