Термодинамика гальванического элемента
В гальваническом элементе протекает ОВР и совершается работа,
равная убыли свободной энергии химической реакции. 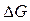 - изобарно – изотермический потенциал или функция Гиббса.
- изобарно – изотермический потенциал или функция Гиббса.
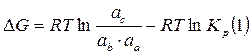
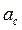 ,
, 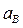 ,
, 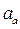 - активные концентрации электролитов;
- активные концентрации электролитов;
(1)- уравнение изотермы химической реакции.
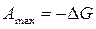
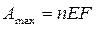
n- Число электронов участвующих в ОВ реакциях
Е- напряжение между двумя электродами внешней цепи в вольтах
F- Число Фарадея.
Т.к. 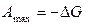

Фундаментальное уравнение электрохимии- уравнение Нернста, по которому рассчитывают потенциалы напряжения электродов.
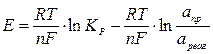
Отсюда видно, что потенциал напряжения электродов зависит от активной концентрации ионов электролита.
Если величину ln Кр обозначить через Е0 – стандартный потенциал электрода, вычисленный при а=с.
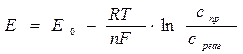
Дата добавления: 2015-09-07; просмотров: 717;
