Энергетика процесса растворения.
Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты - в зависимости от природы вещества. При растворении в воде, например, гидроксида калия, серной кислоты наблюдается сильное разогревание раствора, т.е. выделение теплоты, а при растворении нитрата аммония - сильное охлаждение раствора, т.е. поглощение теплоты. В первом случае осуществляется экзотермический процесс, во втором -эндотермический. Теплота растворения ∆Н - это количество теплоты, выделяющееся при растворении 1 моль вещества. Так, для гидроксида калия она равна +55,65 кДж/моль, а для нитрата аммония -26,48 кДж/моль. Таким образом, теплота растворения имеет отрицательное значение, если при растворении теплота поглощается, и положительное - при выделении теплоты.
Процесс растворения сопровождается значительным возрастанием энтропии системы, так как в результате равномерного распределения частиц одного вещества в другом резко увеличивается число микросостояний системы. Очевидно, при растворении кристаллов происходит их разрушение, что требует затраты энергии. Поэтому растворение должно было бы сопровождаться поглощением теплоты. Если же наблюдается обратный эффект, то это показывает, что одновременно с растворением происходит какое-то взаимодействие между растворителем и растворенным веществом, при котором выделяется в виде теплоты больше энергии, чем ее расходуется на разрушение кристаллической решетки.
Действительно, установлено, что при растворении многих веществ их молекулы (или ионы) связываются с молекулами растворителя, образуя соединения, называемые сольватами (от лат. solvere - растворять); этот процесс называется сольватацией. В частном случае, когда растворителем является вода, эти соединения называются гидратами, а сам процесс их образования – гидратацией.
Важной физико-химической характеристикой растворов является температура кипения и замерзания. Каждое вещество характеризуется определенными температурами кипения и плавления (или кристаллизации). Так, вода при нормальном атмосферном давлении (101,3 кПа) кристаллизуется при 0°С и кипит при 100°С. Присутствие растворенного вещества повышает температуру кипения и понижает температуру замерзания растворителя. Таким образом, раствор кристаллизуется и кипит не при определенной температуре, а в некотором температурном интервале. Разность между температурами кипения раствора и чистого растворителя называют повышением температуры кипения раствора 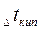 ; Разность между температурами замерзания чистого растворителя и раствора называют понижением температуры замерзания раствора
; Разность между температурами замерзания чистого растворителя и раствора называют понижением температуры замерзания раствора 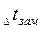 :
:
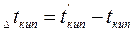

где  и
и 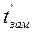 - температуры кипения и замерзания раствора;
- температуры кипения и замерзания раствора; 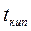 и
и 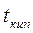 - температуры кипения и замерзания чистого растворителя.
- температуры кипения и замерзания чистого растворителя.
Для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорционально концентрации раствора (закон Рауля):
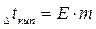
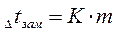
где m - моляльная концентрация раствора; Е -эбуллиоскопическая постоянная, т.е. повышение температуры кипения одномоляльного раствора; К - криоскопическая постоянная, т.е. понижение температуры замерзания одномоляльного раствора.
Параметры растворов электролитов, зависящие от концентрации, такие, как давление пара, понижение температуры замерзания, осмотическое давление, повышение температуры кипения, не подчиняются закону Рауля, так как диссоциация электролита приводит к тому, что общее чис о частиц растворенного вещества в растворе возрастает по сравнению с раствором неэлектролита той же концентрации. Для количественного описания изменения некоторых свойств растворов электролитов Вант-Гоффом был введен изотонический коэффициент. Таким образом, для электролитов:
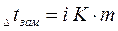
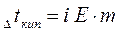
Физический смысл изотонического коэффициента:


3.2 Два вида электролитов: сильные и слабые электролиты. Электролитическая диссоциация в водных растворах. Ионное произведение воды. Водородный показатель.
Дата добавления: 2015-09-07; просмотров: 1779;
