Классификация дисперсных систем.
Если в какой-либо среде распределено в виде очень мелких частиц другое вещество, то такая система называется дисперсной. При этом в дисперсных системах различают дисперсную фазу – мелкораздробленное вещество и дисперсную среду – однородное вещество, в котором распределена дисперсная фаза.
В качестве примера могут быть названы следующие системы:
1. воздух, где мы можем рассматривать азот как дисперсионную среду (его около 78 %), в которой распределены частицы других газов ( 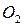 ,
, 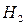 и др.);
и др.);
2. туман – мелкие капельки воды, распределённые в дисперсионной среде – воздухе;
3. дым – мелкие частицы твёрдых веществ, распределённые в воздухе.
Следующие три типа системы являются наиболее важными. Им соответствуют, например:
4. раствор воздуха в воде;
5. раствор спирта в воде;
6. раствор сахара в воде;
7. раствор водорода в палладии;
8. вода в сливочном масле;
9. синяя каменная соль, цвет которой обусловлен тем, что в NaCl
(дисперсионной среде) распределены очень мелкие частицы металлического натрия (дисперсной фазы).
Свойства дисперсных систем, в первую очередь их устойчивость, в очень сильной степени зависят от размеров распределённых частиц.
В зависимости от размера частиц все дисперсные системы подразделяют на группы:
1. Взвеси (суспензии, эмульсии), у которых частицы имеют размер 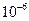 м и более.
м и более.
Например: эмульсия (ж + ж) – молоко, майонез; эмульсия (т + ж) – масло.
2. коллоидные системы, размер частиц 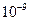 м -
м - 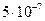 м (1-500 нм).
м (1-500 нм).
Коллоидные частицы состоят из ядра, имеют противоионы и молекулы растворителя. Адсорбированные ионы и противоионы с растворителем образуют адсорбированный слой. Вокруг частиц находится диффузный слой ионов. Коллоидная частица и диффузный слой образуют электронейтральную мицеллу.

AgJ
золь
3. Истинные растворы. Размер частиц дисперсной фазы меньше 1 нм. Например, раствор сахара в воде, раствор солей.
Дата добавления: 2015-09-07; просмотров: 715;
