Химические свойства. В химическом отношении это высоко реакционноспособные вещества, что обусловлено наличием в их молекуле карбонильной группы.
В химическом отношении это высоко реакционноспособные вещества, что обусловлено наличием в их молекуле карбонильной группы.
Высокая реакционная способность альдегидов объясняется:
а) наличием поляризованной двойной связи
б) дипольным моментом карбонила
в) наличием частичного положительного заряда на атоме углерода карбонила
σ-
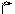

 O
O
 R - C
R - C
σ+ H
Двойная связь между С и О, в отличие от двойной связи между двумя углеродами, сильно поляризована, так как кислород обладает значительно большей электроотрицательностью, чем углерод, и электронная плотность π-связи смещается к кислороду. Такая высокая поляризация определяет электрофильные свойства углерода карбонильной группы и его способность реагировать с нуклеофильными соединениями (вступать в реакции нуклеофильного присоединения). Кислород группы обладает нуклеофильными свойствами.
Характерны реакции окисления и нуклеофильного присоединения
I. Реакции окисления.
Альдегиды легко окисляются. Окисление альдегидов до кислот происходит под влиянием как сильных, так и слабых окислителей.
Многие металлы – серебро, ртуть, висмут, медь, восстанавливаются из растворов их солей, особенно в присутствии щелочи. Это отличает альдегиды от других органических соединений, способных к окислению – спиртов, непредельных соединений, для окисления которых необходимы более сильные окислители. Следовательно, реакции окисления альдегидов комплексно связанными катионами ртути, меди, серебра в щелочной среде можно применять для доказательства подлинности альдегидов.
I. 1.Реакция с аммиачным раствором нитрата серебра (реакция серебряного зеркала) рекомендуется ФС для подтверждения подлинности веществ с альдегидной группой.В основе окисление альдегида до кислоты и восстановление Ag+ до Ag↓.
AgNO3 + 2NH4OH → [Ag(NH3)2]NO3 +2H2O
НСОН + 2[Ag(NH3)2]NO3 + H2O → HCOONH4 + 2Ag↓+ 2NH4NO3+ NH3↑
Формальдегид, окисляясь до аммонийной соли муравьиной кислоты, восстанавливает до металлического серебро, которое осаждается на стенках пробирки в видеблестящего налета «зеркала» или серого осадка.
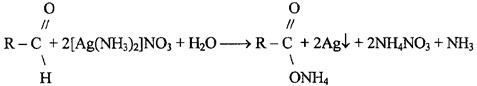
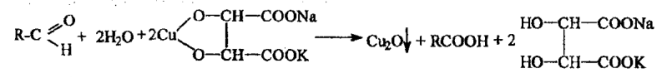
I. 2. Реакция с реактивом Фелинга (комплексное соединение меди (II) с калий-натриевой солью винной кислоты). Альдегиды восстанавливают соединение меди (II) до оксида меди (I), образуется кирпично-красный осадок. Готовят перед употреблением).
реактив Феллинга 1 - раствор CuSO4
реактив Феллинга 2 – щелочной раствор калий-натриевой соли винной кислоты
При смешавании 1:1 реактивов Феллинга 1 и 2 образуется синее комплексное соединение меди (II) с калий-натриевой солью винной кислоты:
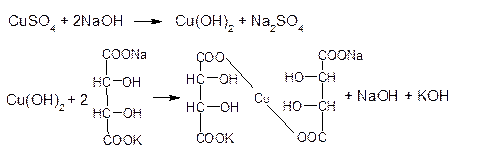
синее окрашивание
При добавлении альдегида и нагревании синее окрашивание реактива исчезает, образуется промежуточный продукт - желтый осадок гидроксида меди (I), сразу разлагающийся на красный осадок оксида меди (I) и воду.
2KNa[Cu(C4H4O6)2] +R-COH +2NaOH + 2KOH →R-COONa +4KNaC4H4O6+2CuOH↓ + H2O
желтый
2CuOH↓ →Cu2O↓ + H2O
Желтый осадок кирпично-красный осадок
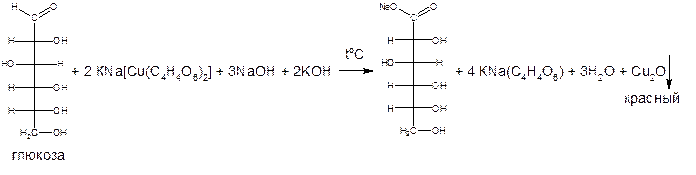
В учебниках иная общая схема реакции
I. 3. Реакция с реактивом Несслера (щелочной раствор тетрайодмеркурат (II) калия). Формальдегид восстанавливает ион ртути до металлической ртути – осадок темно-серого цвета.
R-COH + K2[HgI4] +3KOH → R-COOK + 4KI + Hg↓ + 2H2O
черный
II. Реакции нуклеофильного присоединения.
На атоме углерода расположен центр электрофильности. Альдегиды реагируют с нуклеофильными реагентами. В эту группу входят реакции:
реакции присоединения с сульфитами,
конденсации альдегидов с фенолами,
реакции замещения и конденсации альдегидов с аминами.
II. 1. Реакции присоединения с сульфитами
а)Реакция с фуксинсернистой кислотой Продукт взаимодействия альдегидов с фуксинсернистой кислотой – окрашенное в красно-фиолетовый (пурпурно-красный) цвет соединение (краситель). При добавлении минеральных кислот окрашивание исчезает, за исключением формальдегида, в присутствии которого окраска сохраняется.
 |
Варианты записи реакции с фуксинсернистой кислотой
Дата добавления: 2015-09-07; просмотров: 1551;
