Химия кислорода и его соединений
Кислород - самый распространенный элемент, на его долю приходится 47,2% по массе литосферы и атмосферы вместе взятых. Кислород взаимодействует с большинством химических элементов. Белки, жиры и углеводы являются органическими кислородосодержащими веществами. Как животные, так и растения при дыхании поглощают атмосферный кислород. Теплокровные животные погибают без кислорода в течении нескольких минут. С участием кислорода идет минерализация растительных или животных остатков в почве до NH3, CO2 и H2O. Без аэрации почва не может быть плодородной.
Кислород представляет собой газ без цвета, без вкуса, без запаха. Кислород может быть получен при сжижении и разделении воздуха. В лаборатории кислород получают разложением перманганата калия или разложением хлората калия - бертолетовой соли:
2KMnO4 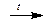 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
2KClO3 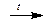 2KCl + 3O2
2KCl + 3O2
Известны две аллотропические модификации кислорода: кислород О2 и озон О3. Озон может быть получен из кислорода под действием электрического разряда или ультрафиолетового излучения:
3О2 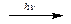 2О3
2О3
Озон - сильный окислитель. его активность обусловлена распадом его молекул с образованием атомарного кислорода, который более активен, чем молекулярный кислород:
О3 ® О2 + О
Молекулярный кислород (степень окисления равна нулю) является активным окислителем. Кислород в низшей степени окисления -2 ( в оксидах , в воде) окислителем быть не может. В промежуточной степени окисления -1, например, в пероксиде водорода, кислород может иметь как окислительные, так и восстановительные свойства. С сильными окислителями пероксид водорода проявляет восстановительные свойства, окисляясь до кислорода О2.
2KMnO4 + 3H2SO4 + 5H2O2 ® 5O2 + 2MnSO4 + K2SO4 + 8H2O
С сильными восстановителями пероксид водорода проявляет окислительные свойства. Кислород при этом восстанавливается до степени окисления -2.
2KI + H2SO4 + H2O2 ® I2 + K2SO4 + 2H2O
Пероксид водорода может быть получен действием кислот на пероксиды металлов:
BaO2 + H2SO4 ® BaSO4 + H2O2
Окислительная активность пероксида водорода, обуславливающая его обеззараживающие свойства, связана с образованием в момент выделения атомарного кислорода:
Н2О2 ® Н2О + О
Дата добавления: 2015-09-07; просмотров: 1425;
