ПОЧВЕННЫХ МИКРООРГАНИЗМОВ
МЕТОДЫ ОПРЕДЕЛЕНИЯ СОСТАВА
И АКТИВНОСТИ
ПОЧВЕННЫХ МИКРООРГАНИЗМОВ
Мир почвенных микроорганизмов весьма разнообразен, однако здесь в основном будут рассмотрены бактерии, микроскопические грибы, актиномицеты и близкие к ним существа. Эти организмы обычно изучаются в курсах микробиологии.
Прежде всего встает вопрос об общем количественном анализе микроорганизмов почвы. Наиболее объективный метод такого анализа — прямое микроскопирование почвы, принцип которого был предложен С. Н. Виноградским. При этом методе готовят почвенную суспензию и под микроскопом в определенном ее объеме подсчитывают общее число микроорганизмов. При подготовке почвенной суспензии целесообразно использовать один из рекомендуемых способов диспергирования почвы и десорбции микроорганизмов из почвенных частиц: растирание почвы, обработка поверхностно-активными веществами, ультразвуком и т. д. Пересчетом можно установить, сколько микроорганизмов приходится на 1 г исследуемой почвы. С. Н. Виноградский готовил препараты на предметном стекле и просматривал их под оптическим микроскопом. В поле зрения можно было видеть палочковидные бактерии, мелкие и крупные кокки, обрывки мицелия грибов и актиномицетов и другие микроорганизмы.
Определение числа бактериальных клеток прямым микроско-пированием облегчается при использовании люминесцентного микроскопа, красителей микробных клеток. При этом микроорганизмы лучше видны среди мелких частиц почвы. В качестве красителей применяют акридиновый оранжевый, изотиоционат и другие вещества.
При окрашивании акридиновым оранжевым красный тон приобретают мертвые клетки, зеленый — живые. Для окраски грибного мицелия и установления его длины при прямом микроскопи-ровании пользуются диацетатом флуоресцеина.
Иногда прямую микроскопию применяют для микробиологического анализа срезов почвы, помещенных в метилметакрилат, фильтратов почвенных суспензий на фильтрах Зейца, окрашенных дианиловым голубым или метиленовым синим и т. д.
Б. В. Перфильев и Д. Р. Габе для подсчета микроорганизмов в почве рекомендовали пользоваться сконструированной ими капиллярной камерой, глубина которой не превышает 30—40 мкм, а ширина не более поля зрения микроскопа. Подсчитав число микроорганизмов в капилляре, можно затем сделать пересчет на 1 г почвы.
Д. И. Никитин использовал для прямого подсчета микроорганизмов почвы электронный микроскоп. С его помощью наряду с обычными микроорганизмами можно£ -обнаружить множество мельчайших форм микроскопических существ. Сейчас для прямого анализа микрофлоры почвы начинают применять сканирующий электронный микроскоп, дающий объемное изображение анализируемых объектов (рис. 52).
Прямые методы дают представление об общем количестве микроорганизмов в почве. Однако внешний облик микроорганизмов не позволяет судить об их функциях, поэтому необходимо дополнительно определить принадлежность микроскопических существ, обнаруженных в почве, к разным систематическим и физиологическим группам.
Состав отдельных групп микроорганизмов (бактерии, актино-мицеты, грибы и т. д.) может быть уточнен посевом почвенной суспензии на разные по составу твердые питательные среды, на которых затем развиваются зародыши тех или иных групп микроорганизмов. В практике обычно используют агаризованные или желатинизированные, а иногда силикогелевые питательные среды.
После инкубации засеянных чашек в термостате подсчитывают выросшие на твердой питательной среде колонии. Допуская, что каждая колония произошла из одного зародыша того или иного микроорганизма, устанавливают число клеток во взятом образце почвы. Подобный пересчет имеет ряд условностей. Например, бактериальные колонии могут вырасти на питательной среде не из одной клетки, а из группы их, оставшихся неразделенными в почвенной взвеси. Колонии грибов и актиномицетов вырастают из обрывков мицелия разной величины и из спор. Дифференцировать колонии, образованные из спор и из мицелия этих микроорганизмов, невозможно. Поэтому правильнее богатство почв мицелиальными микроорганизмами учитывать, измеряя длину их мицелия при прямом микроскопировании.
Представляют значительный интерес примерные соотношения числа микроорганизмов, подсчитываемых в одной и той же почве различными методами. В таблице 7 приведены соответствующие данные Д. И. Никитина для дерново-подзолистых почв Подмосковья.
Как видно, прямая микроскопия дает показатели, во много раз превосходящие те, которые получены методом посева. Это объясняется прежде всего тем, что при прямом анализе подсчитывают живые и мертвые клетки. Число последних может быть велико, так как индивидуальная жизнь микроорганизмов очень
коротка. Однако численность мертвых микробов в почве обычно не превышает 25% их общего числа.
Общие показатели численности микробов, как бы условны они ни были, представляют интерес. На их основании можно примерно вычислить массу совокупности микроорганизмов в почве. Как показывают подсчеты, она составляет десятые доли процента массы почвы. По мере перехода от северных почв к южным процент микробной массы в них увеличивается.
В последнее время для установления микробной массы почвы применяют косвенный метод, рекомендованный Д. Дженкинсоном. Почву обрабатывают летучим антисептическим веществом, убивающим микробов. После дефумигации почвы определяют количество выделяемой углекислоты, которая в основном образуется из отмерших клеток. Затем расчетным путем можно примерно установить массу органического вещества микробов.
Предложены и другие косвенные методы определения в почве массы отдельных групп микроорганизмов — для бактерий по специфической для прокариот мурамовой кислоте, для грибов — по хитину, входящему в состав их клеток, для водорослей — по количеству хлорофилла и т. д. Почвенную биомассу можно примерно измерять по компонентам микробной клетки — АТФ и ДНК, но более точным биохимическим методом считают ее установление по содержанию аденозина и аденина при помощи флуорометрии.
В последнее время сотрудники Л\ГУ предложили оригинальный «регидрационный метод». Почву подсушивают при температуре не выше 70°С, что нарушает барьер проницаемости микробных клеток, и в водную или солевую вытяжку, -переходит часть внутренних компонентов клетки. Их концентрация может быть измерена с использованием определенного коэффициента и уста- ' новлена биомасса микроорганизмов в почве.
По обобщенным данным Д. Г. Звягинцева, сырая масса бактерий в пахотном слое различных почв колеблется от 0,5 до 15 т/га, микроскопических грибов — от 5 до 20 т/га.
В связи с тем что при микроскопическом исследовании почв отдельные показатели являются условными, надежнее использовать одновременно несколько методов.
При анализе почв нередко учитывают число отдельных физиологических групп микроорганизмов. Это делают так называемым методом титра, при котором твердые или жидкие избирательные (элективные) питательные среды для определенных групп микроорганизмов заражают разными разведениями почвенной суспензии. Устанавливая после выдерживания в термостате степень разведения, показавшего наличие искомой группы микроорганизмов, можно простым пересчетом определить численность ее представителей в почве. Таким путем узнают, насколько богата почва нитрификаторами, денитрификаторами, целлюлозоразлагаю-щими и другими микроорганизмами.
Метод титра используют при учете почвенных водорослей и простейших. Для водорослей берут минеральные среды, которые после заражения рядом разведений почвенной суспензии выдерживают при искусственном освещении. При учете простейших, используя также разведения почвенной суспензии, инфицируют среды, содержащие микроорганизмы, которыми простейшие могут питаться.
Для характеристики типа почвы и ее состояния важны не только показатели численности разных групп микроорганизмов, но и анализ состояния в почве отдельных их родов и видов. За редким исключением, физиологические группы микроорганизмов очень разнообразны. Внешняя обстановка может резко менять видовой состав почвенных микроорганизмов, но почти не отражается на числе их физиологических групп. Поэтому при анализе почвы важно стремиться установить состояние отдельных видов микроорганизмов.
Совершенно очевидно, что диагностика до вида, даже всех обычных сапрофитов почвы, невозможна. Поэтому сейчас стремятся выявить микроорганизмы, характерные для определенных почв. Список подобных индикаторных микроорганизмов пока не столь велик, но он будет возрастать по мере развития почвенной микробиологии. Однако уже в настоящее время определение индикаторных микроорганизмов помогает установить тип почвы, ее окультуренность и характер воздействия на почву агротехнических и агрохимических приемов.
Приведенные методы анализа позволяют определить численность микробов или отдельных их групп в почве, но не показывают их состояния (распределения, взаимосвязей и т. д.). Для выяснения этого вопроса существует ряд подходов. Так, в 30-х годах текущего столетия академик АН УССР Н. Г. Холодный рекомендовал изучать микробные пейзажи почвы с помощью «стекол обрастания». При работе по этому методу в почву закладывают предметные стекла и оставляют там на определенный срок. Поверхность стекол обрастает микрофлорой, характерной для данной почвы. Микроскопический анализ стекол позволяет получить представление как о составе, так и о взаимоотношениях микроорганизмов в почве.
Новые возможности в области изучения микробных пейзажей почвы открывает капиллярный метод Б. В. Перфильева и Д. Р. Габе. Для изучения группового состава микроорганизмов почв ими сконструирован капиллярный прибор — педоскоп, который может быть использован и для работы с грунтами. Педоскоп представляет собой набор капиллярных ячеек с 5—6 прямоугольными каналами. Ячейки закладывают в пазы широкого стеклянного держателя (рис. 53) и заполняют полужидкой агаризованной средой, содержащей в качестве органического субстрата гумусовые вещества (фульвокислоты). Это создает для микроорганизмов условия, близкие к почвенным. Педоскоп выдерживают в почве 1,5—2 месяца, затем просматривают его под микроскопом. С помощью этого метода удается выявить характерные для почвы микробные ассоциации.
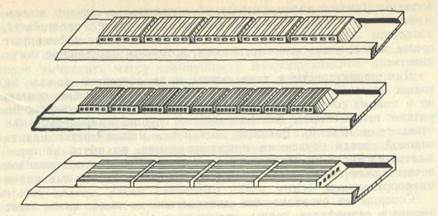
Рис. 53. Педоскоп с различными типами капиллярных ячеек (по Б. В. Перфильеву и Д. Р. Габе).
Важно установить не только состав микронаселения почвы, но и ее суммарную биохимическую активность. Одним из показателей такой активности служит нитрификационная способность почвы, характеризующая мобилизуемость азотного запаса почвы в результате деятельности микроорганизмов. Нитрификационную способность устанавливают по нарастанию в почве количества нитратов после выдерживания ее при определенных условиях в термостате. Описанная проба свидетельствует о потенциальной способности почвы накапливать то или иное количество минерального азота. В ряде случаев этот показатель важен для практики.
Если в начале опыта в почву внести соль аммония, то по накоплению нитратов можно получить дополнительное представление об энергии работы нитрифицирующих бактерий.
При изучении почвенной биодинамики определяют выделение почвой СО2 («дыхание» почвы). Данная проба показывает в основном энергию процесса разложения в почве органических соединений.
Можно установить быстроту распада в почве любого химического вещества путем учета продуктов распада или убыли внесенного в почву соединения. Для этого в почву помещают полосы бумаги или лучше льняной ткани, закрепленной на стекле,—метод «аппликаций». Периодически тесты извлекают из почвы, просматривают и фиксируют зоны распада материала (рис. 54).
Метод аппликаций весьма показателен при решении некоторых агрономических задач. С его помощью, например, можно выявить интенсивность процессов в разных горизонтах пахотного слоя, установить действие различных удобрений, мелиорирующих средств и т. д.
Для оценки активности почвы могут быть использованы и ферментные показатели. Ферменты, находящиеся в почве, в основном продуцируются микроорганизмами. Поэтому между фермен-
тативными показателями почвы и определенными микробиологическими процессами намечается коррелятивная зависимость. Подобная связь устанавливается, например, между активностью инвертазы и интенсивностью дыхания почвы, активностью окси-дазы И динамикой нитратов. Абсолютное значение отдельных ферментных показателей, по данным А. Ш. Галстяна, Т. А. Щербаковой, Ф. X. Хазиева и других ученых, различно у почв разных климатических зон, что может быть использовано в диагностических целях.
Следует отметить, что при отмирании микроорганизмов окружающая среда еще более обогащается ферментами, которые в значительной части адсорбируются почвенными коллоидами, что способствует их стабилизации. Наши исследования показали, что ферментные процессы в почве прекращаются при значительно более низкой влажности, чем деятельность микроорганизмов. Следовательно, биохимические процессы могут протекать даже в относительно сухих почвах. Определение активности ферментов почвы, как показано А. Ш. Галстяном, может дать представление об их плодородии.
В приведенном обзоре указаны лишь основные подходы к выявлению состава и активности почвенных микроорганизмов.

Рис. 54. Распад льняной ткани в черноземе: а, б, в — в течение 1, 2 и 3 месяцев соответственно.
Ткани в черноземе: а,б,в-в течение 1,2,и 3 месяцев соответственно.
В зависимости от теоретических или практических задач, стоящих перед почвенными микробиологами, следует пользоваться различными комплексами методов анализа почвы *.
Дата добавления: 2015-09-29; просмотров: 1299;
