ПОСТУЛАТЫ БОРА
ЛЕКЦИЯ № 11
ОПЫТ РЕЗЕФОРДА. ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА
В начале ХХ века уже было известно, что в состав атома входят электроны. Поскольку атом электрически нейтрален, а электрон имеет отрицательный заряд, то было очевидным, что в состав атома входит и положительный заряд. Масса атома значительно превышала массу его электронов. Резерфорд поставил задачу опытным путём изучить распределение положительного заряда внутри атома.
В своём опыте он подверг бомбардировке альфа-частицами тонкую золотую фольгу. Альфа-частицы имели положительный заряд, а их масса почти в 2000 раз превышала массу электрона. Золотая фольга была очень тонкой толщиной 10–6 м, но по атомным меркам её толщина составляла около 10000 атомных слоёв. Ожидалось, что золотая фольга станет серьёзной преградой на пути альфа-частиц, но оказалось напротив. Основной поток альфа-частиц свободно пролетал сквозь преграду. Из этого вытекало, что атом внутри практически пустой, т.е. положительный заряд занимает очень малый объём атома. Однако отдельные альфа-частицы (очень малая часть) отклонились на значительные углы от первоначального направления. Из этого вытекало, что с маленьким положительным ядром атома связана практически вся его масса.
На основании результатов опыта Резерфорд предложил следующую модель атома. В центре атома расположено положительное массивное ядро, вокруг которого вращаются электроны как планеты вокруг Солнца. Из опыта оценили размер ядра как 10–14 м, когда размер атома, полученный ранее, составлял порядка 10–10м. Электроны на орбитах атома удерживала сила кулоновского притяжения, действующая между разноимёнными зарядами.
ПОСТУЛАТЫ БОРА
Планетарная модель атома была наилучшей из всех предложенных, однако имела существенные противоречия. При движении заряженной частицы с ускорением должна излучаться электромагнитная волна. В модели атома электроны имеют центростремительное ускорение, однако при этом атом не излучает волны. Более того, при излучении волны атом должен терять энергию, радиус орбиты должен уменьшаться и электрон должен упасть на ядро. Возникали непреодолимые противоречия, из которых уже следовало, что классический подход к описанию атома не совсем подходит или совсем не подходит.
Для того чтобы пассивно не ждать, когда будет придумана новая теория, а конструктивно работать с планетарной моделью атома Бор предложил принять три постулата. Постулаты это некоторые утверждения, заложенные в основу новой теории. Они могут обсуждаться или доказываться, но не в рамках этой новой теории.
Первый постулат. Существуют стационарные состояния атома, находясь в которых, он не излучает энергии.
Второй постулат.В стационарном состоянии атома электрон, двигаясь по круговой орбите, имеет квантованные (дискретные) значения момента импульса, которые удовлетворяют условию
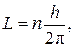 (1)
(1)
где L = mur ¾ момент импульса электрона; m и u — его масса и скорость; r — радиус его орбиты; n = 1, 2, 3,..., h ¾ постоянная Планка.
Третий постулат.Испускание (или поглощение) света атомом происходит только тогда, когда электрон переходит из одного стационарного состояния в другое. При этом испускается (или поглощается) один световой фотон, энергия которого определяется соотношением
hn = Wn - Wi, (2)
где Wnи Wi ¾ энергия верхнего и нижнего состояния соответственно. Если происходит переход из состояния с меньшей энергией в состояние с большей энергией, то наблюдается поглощение энергии (света). Испускание наблюдается при уменьшении энергии атома, а поглощение при увеличении. Отсюда
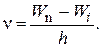 (3)
(3)
ЛИНЕЙЧАТЫЕ СПЕКТРЫ И ЗАКОНОМЕРНОСТИ В НИХ
Изучая соотношение частот разных спектральных линий в видимой области спектра атома водорода, Бальмер вывел эмпирическую формулу, которая описывала наблюдаемые частоты и позволила предсказать ряд других, ранее не наблюдавшихся. Позднее другими исследователями были получены аналогичные соотношения для частот спектральных линий, входящих в другие области спектра водорода (ультрафиолетовую и инфракрасную). С учётом всех этих данных обобщённая формула Бальмера имеет вид:
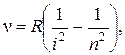 (4)
(4)
где n — частота, испускаемого света; i = 1, 2, 3, 4 — целое число, характеризующее серию линий; n = i +1, i + 2, ... — целое число, характеризующее конкретную линию серии; R = 3,28·1015с–1 — постоянная Ридберга. При i = 1 описывается так называемая серия Лаймана в ультрафиолетовой области, при i = 2 — серия Бальмера в видимой области, при n = 3, 4, 5 — серии Пашена, Брэкета и Пфунда в инфракрасной области.
Простота формулы Бальмера и точность описания спектра предполагала, что эта формула не формальна, а имеет глубокий смысл, т.е. её можно получить теоретически. Бор рассмотрел атом водорода с учётом предложенных постулатов.
Дата добавления: 2015-09-29; просмотров: 1336;
