Химические свойства. Двух- и трехатомные спирты вступают в аналогичные одноатомным спиртам реакции
Двух- и трехатомные спирты вступают в аналогичные одноатомным спиртам реакции. Однако различное количество гидроксильных групп в спиртах определяет и некоторые их особенности.
Кислотные свойства. С увеличением числа гидроксильных групп в молекуле кислотные свойства спиртов усиливаются. Это связано с электроноакцепторным влиянием одной гидроксильной группы на другую (–I-эффект).
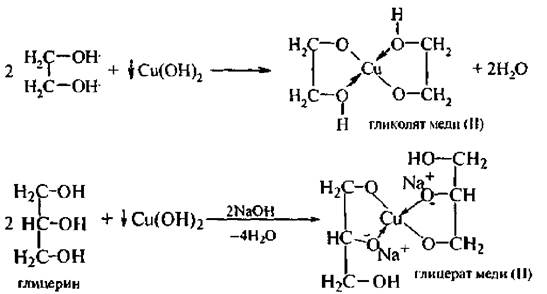
Гликоли являются более сильными ОН-кислотами, чем одноатомные спирты. Они образуют алкоголяты (гликоляты) не только со щелочными металлами, но и другими активными металлами (Al, Mg и т. д.), а также со щелочами и гидроксидами тяжелых металлов.

α-Гликоли способны реагировать с гидроксилом меди (II) с образованием комплексных соединений. Данная реакция является качественной на спирты, содержащие α-гликольный фрагмент.
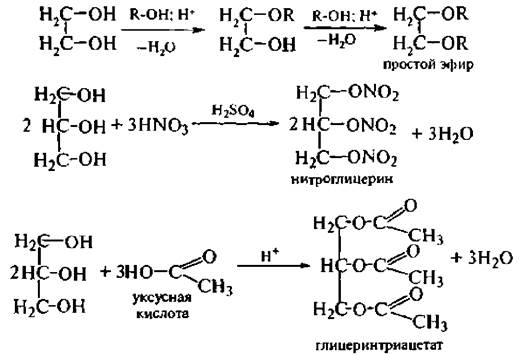
Образование простых и сложных эфиров. Гликоли образуют неполные и полные производные при взаимодействии со спиртами (простые эфиры), кислородсодержащими минеральными или карбоновыми кислотами (сложные эфиры).
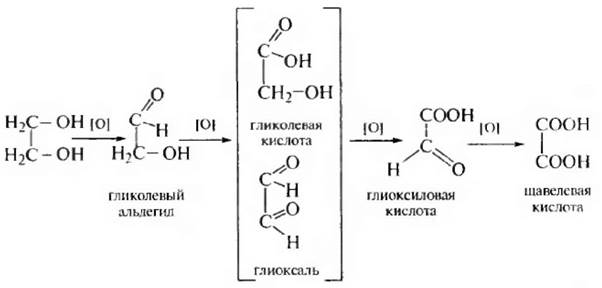
Окисление. Окисление гликолем в зависимости от природы окислителя может протекать по-разному:
Для идентификации α-гликолей используют реакцию окисления йодной кислотой НIO4.
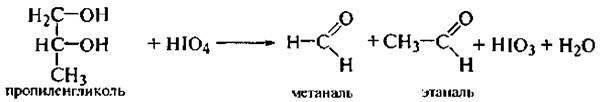
При окислении происходит разрыв химической связи между углеродными атомами α-гликольного фрагмента и образуются соответствующие карбонильные соединения. По продуктам окисления устанавливают положение диольного фрагмента в молекуле.
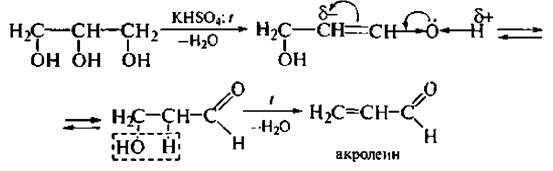
Дегидратация. Гликоли под действием водотнимающих реагентов подвергаются внутри- и межмолекулярной дегидратации. Направление реакций определяется условиями их проведения.
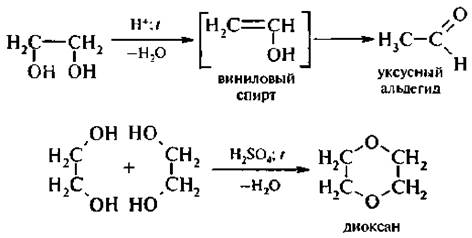
Глицерин подвергается внутримолекулярной дегидратации с образованием непредельного альдегида акролеина:
Поликонденсация. Этиленгликоль в результате реакции поликонденсации способен образовывать полиэфир – полиэтиленгликоль HO–[–CH2–CH2–O]n–H
Полиэтилен гликоль с молекулярной массой до 400 используют в фармации в качестве растворителя лекарственных веществ, основы для мазей, связывающего вещества в производстве таблеток.
ПРОСТЫЕ ЭФИРЫ
Простыми эфирами называют органические соединения, в которых два углеводородных радикала соединены атомом кислорода.
Общая формула простых эфиров R–О–R', где R, R' –- углеводородные радикалы.
Различают симметричные простые эфиры (содержат одинаковые углеводородные радикалы) и несимметрические или смешанные (углеводородные радикалы различны).
По радикало-функциональной номенклатуре названия простых эфиров образуют путем добавления к названию углеводородных радикалов суффикса -овый и слова эфир. В смешанных простых эфирах углеводородные радикалы перечисляют в алфавитном порядке.

По заместительной номенклатуре ИЮПАК простые эфиры рассматривают как производные углеводородов, в которых атом водорода замешен алкоксигруппой RO–. Более сложный по структуре радикал принимают за родоначальную структуру.

Простые эфиры – бесцветные легколетучие жидкости с характерным запахом, плохо растворимы в воде, хорошо растворимы в органических растворителях.
Дата добавления: 2015-09-29; просмотров: 2304;
