Кислотные свойства
В водных растворах карбоновые кислоты диссоциируют с образованием карбоксилат-иона:
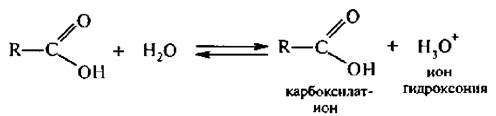
Строение карбоксилат-иона можно представить с помощью двух граничных структур:
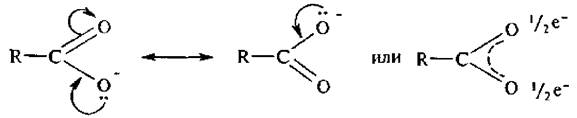
В карбоксилат-ионе оба атома кислорода равноценны, отрицательный заряд равномерно распределен между ними.
Сила карбоновых кислот зависит от стабильности образовавшегося карбоксилат-иона и степени делокализации отрицательного заряда в нем.
На силу карбоновых кислот также оказывает влияние структура углеводородного радикала и природа заместителей в нем, Электроно-донорные заместители дестабилизируют карбоксил анион и ослабляют кислотные свойства. Электроноакцепторные заместители за счет –I-эффекта способствуют делокализации отрицательного заряда в карбоксил анионе, повышая его устойчивость, что приводит к повышению кислотных свойств.
Кислотность ароматических кислот превышает кислотность алифатических (кроме муравьиной кислоты) и ненасыщенных карбоновых кислот, это объясняется лелокализацией отрицательного заряда бензоат-иона по сопряженной системе бензольного кольца.
Образование солей. При взаимодействии с активными металлами, основными оксидами, гидроксидами и карбонатами щелочных металлов карбоновые кислоты образуют соли:
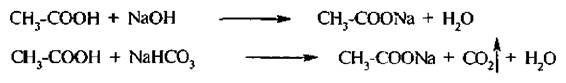
Взаимодействие с гидрокарбонатом натрия является простейшей качественной реакцией на карбоксильную группу.
Названия солей образуются от названий анионов карбоновых кислот:

Соли пропионовой кислоты – пропионаты, масляной – бутираты и т д.
Реакции нуклеофильного замещения. Благодаря наличию дробного положительного заряда на атоме углерода карбоксильной группы карбоновые кислоты способны вступать в реакции нуклеофильного замещения (SN).
Взаимодействие со спиртами (реакция зтерификации). Карбоновые кислоты реагируют со спиртами при нагревании в кислой среде. Реакция протекает с образованием сложных эфиров.
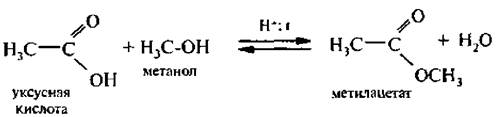
Реакция этерификации обратима, и чтобы сместить равновесие в сторону образования сложного эфира, необходим избыток спирта или кислоты или же удаление воды.
Механизм реакции этерификации:
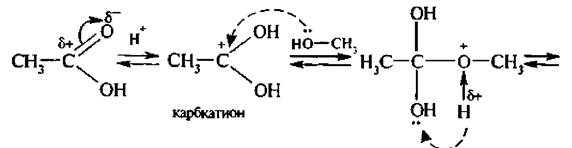
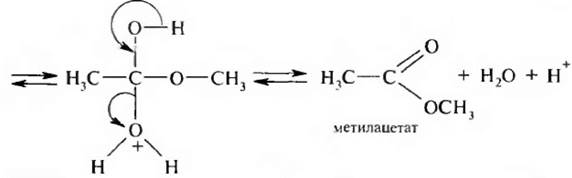
Карбоновая кислота на первой стадии протонируется по атому кислорода карбонильной группы с образованием карбкатиона, электрофильные свойства которого значительно выше, чем у исходной кислоты.
Карбкатион присоединяет молекулу спирта за счет неподеленной пары электронов атома кислорода гидроксильной группы с образованием оксониевого иона, который стабилизируется путем отщепления молекулы воды и протона. В результате образуется сложный эфир.
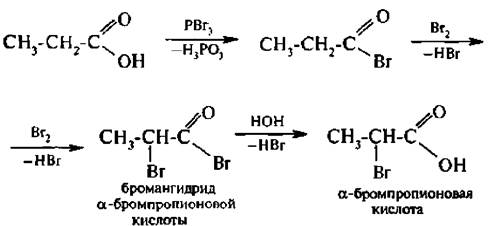
Взаимодействие с галогенирующилт реагентами. При действии на карбоновые кислоты хлоридов фосфора (III) и (V), бромида фосфора (III) или тионилхлорида образуются галогенангидрнды карбоновых кислот:
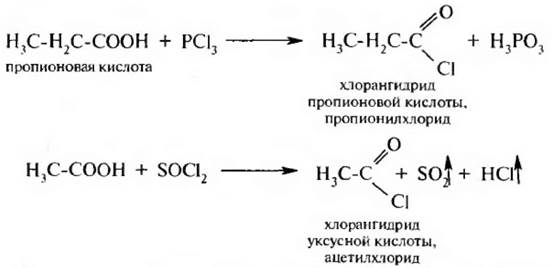
Галогенангидриды кислот используются как ацилирующие реагенты.
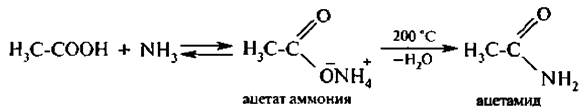
Взаимодействие с аммиаком и аминами. При взаимодействии карбоновых кислот с аммиаком, первичными или вторичными аминами образуются аммониевые соли, которые при пирролизе превращаются в амиды:
Образование ангидридов кислот. При действии водоотнимаюицих средств, таких, как пентаоксид фосфора (Р2O5) или трифторуксусный ангидрид (CF3CO)2O, образуются ангидриды карбоновых кислот:
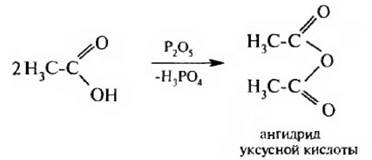
Ангидриды карбоновых кислот являются активными ацилирующими средствами.
Замещение водорода при α-углеродном атоме (реакция Геля – Фольгарда – Зелинского). Под влиянием карбоксильной группы, которая проявляет отрицательный индуктивный эффект (–I), увеличивается подвижность атомов водорода при α-углеродном атоме.
При взаимодействии карбоновых кислот с галогенами в присутствии тригалогенилов фосфора атом водорода при α-углеродном атоме вмешается на галоген.
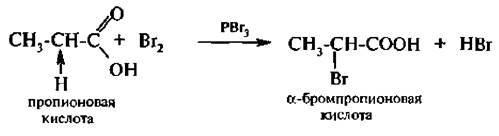
В результате реакции образуются галоген карбоновые кислоты. Реакция протекает через стадию образования галогенангидридов, которые галогенируются легче, чем кислоты:
Окисление Монокарбоновые кислоты устойчивы к действию окислителей, кроме муравьиной кислоты, которая легко окисляется КМnO4 и другими окислителями с образованием угольной кислоты:
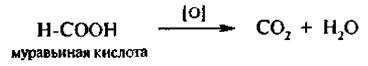
В связи с особенностью строения муравьиная кислота обладает восстанавливающей способностью, она подобно альдегидам дает реакцию «серебряного зеркала»:

Отличительной реакцией муравьиной кислоты является также реакция ее разложения при нагревании с конц. H2SO4,
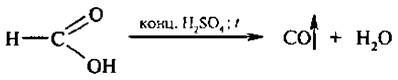
В результате выделяется оксид углерода (II) и вода.
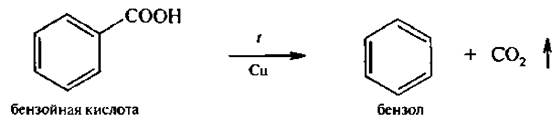
При нагревании выше 200°С ароматические карбоновые кислоты в присутствии катализатора декарбоксилируются:
23. ДИКАРБОНОВЫЕ КИСЛОТЫ
Дикарбоновыми кислотами называют производные углеводородов, содержащие в своем составе две карбоксильные группы,
Дата добавления: 2015-09-29; просмотров: 4207;
