Вещество Температура
самовоспламенения,°С
Метан 535
Этан 515
Пропан 465
Глава 3. Возникновение процессов горения
| Бутан | |
| Пентан | |
| Гексан | |
| Этилен | |
| Аммиак | |
| Бензол | |
| Сероуглерод |
3.2. Зажигание
Зажигание, как и самовоспламенение, характеризует условия возникновения горения. Эти явления имеют одинаковую природу, описываются одними и теми же дифференциальными уравнениями.
В случае самовоспламенения подводимое к реагирующей системе тепло распределяется по всему объему этой системы. Реакция горения при самовоспламенении протекает практически одновременно во всем объеме системы, а начальный очаг горения возникает в ее центре, где потери тепла минимальны. Одним из наиболее важных параметров при самовоспламенении является объем реагирующей смеси, поскольку от этого параметра существенно зависит отвод тепла в окружающее пространство.
При зажигании* в отличие от самовоспламенения нагревается небольшой объем горючей смеси. Зажигание, т. е. инициирование горения может быть осуществлено накаленным телом, пламенем или электрической искрой. Механизм процесса зажигания близок к механизму самовоспламенения, но более сложен. Критические условия зажигания зависят от свойств горючей смеси, от свойств источника зажигания и от начальных условий распространения пламени.
Основной отличительной особенностью зажигания является протекание реакции окисления, инициируемое локальным источником тепла, а не путем накопления тепла в системе за счет реализации химической реакции. Для процесса зажигания определяющим является наличие большой разности температур между горючей системой и источником зажигания. Размеры системы играют второстепенную роль.
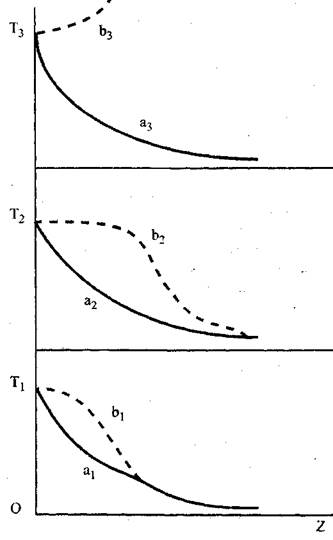
Для выяснения механизма зажигания рассмотрим схему, предложенную Вант-Гоффом (рис. 3.3). Зависимости, представленные на этом
* В теории горения процесс зажигания горючей смеси часто обозначается терминами «вынужденное зажигание» и «вынужденное воспламенение».
Корольченко А.Я. Процессы горения и взрыва
рисунке, характеризуют изменение температуры среды при попадании в нее накаленного шарика. Линии а1, а2 и а3 отражают изменение температуры инертной среды, линии b1, b2и bз - горючей.
|
Рис. 5J. Изменение температуры смеси
в зависимости от температуры
поверхности шарика
Вначале, температура Т1 поверхности шарика, играющего роль источника зажигания, выше температуры газовой смеси, но ниже той температуры, при которой происходит воспламенение смеси. В этом случае распределение температуры T вблизи поверхности шарика изобразится кривой a1 (для инертной среды) и кривой b1- для горючей. Кривая b1располагается несколько выше a1за счет тепловыделения в горючей среде.
Если повысить температуру шарика Т2 > T1, то в инертной среде она будет понижаться быстрее, чем в предыдущем случае. Ее снижение характеризует кривая a2_. В реагирующей смеси, благодаря возрастанию скорости реакции с повышением темпе-
Глава 3. Возникновение процессов горения
ратуры, кривая T(Z) вблизи поверхности шарика будет снижаться медленнее, чем в предыдущем случае. Но величина этой температуры еще не достаточна для возбуждения реакции горения. Температура Т2 является критической температурой, аналогичной температуре самовоспламенения. При повышении температуры поверхности шарика выше критической, например до температуры Т3, в горючей смеси инициируется горение. При этом поверхность уже не участвует в процессе, а определяющими становятся свойства горючей смеси.
Экспериментальные данные свидетельствуют о том, что критическая температура при зажигании выше, чем при самовоспламенении. Это связано с быстрым падением температуры газовой смеси по мере удаления от поверхности нагретого тела. При этом концентрация горючего компонента вблизи поверхности вследствие протекания химической реакции оказывается ниже, чем в остальном объеме. В экспериментах наблюдаются ситуации, когда около нагретого тела реакция протекает, но далее пламя не распространяется.
Математическое описание процесса зажигания выполнено академиком Я. Б. Зельдовичем. Для этого использована следующая модель: горючая газовая смесь заключена между двумя бесконечными плоскими параллельными стенками. Одна стенка имеет температуру Ts, а вторая - Т0 (при этом TS>T0) Стационарное распределение температуры в газовой смеси устанавливается только в том случае, когда температура нагретой стенки не превышает критическую величину и около нее не происходит химическая реакция. При критических условиях, по аналогии с процессом самовоспламенения
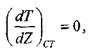 (3.12)
(3.12)
где Z - расстояние от нагретой стенки; индекс «СТ» указывает на то, что градиент температуры относится к слою газа у поверхности стенки.
Распределение температуры в газе описывается уравнением теплопроводности, которое для рассматриваемого случая имеет вид:
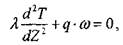 (3.13)
(3.13)
где 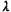 - коэффициент теплопроводности газовой смеси, q - тепловой эффект,
- коэффициент теплопроводности газовой смеси, q - тепловой эффект, 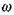 - скорость реакции.
- скорость реакции.
Корольченко А.Я. Процессы горения и взрыва
Скорость реакции зависит от температуры по закону Аррениуса:
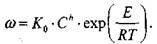
|
(3-14)
 Введем новую переменную
Введем новую переменную
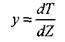
|
и уравнение (3.13) запишем так:
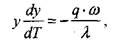
|
(3.15)
Интегрируя (3.15), получим:
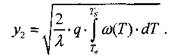
|
(3.16)
Отсюда следует, что поток тепла в газовой смеси отвечает соотношению:
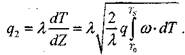
|
(3-17)
Поскольку скорость реакции зависит от температуры, то реакция в газовой смеси между стенками будет в основном протекать в узком слое 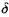 , прилегающем к нагретой стенке. Внутри этого слоя величина Ts- Г при условиях, близких к критическим, будет мала по сравнению с Т.
, прилегающем к нагретой стенке. Внутри этого слоя величина Ts- Г при условиях, близких к критическим, будет мала по сравнению с Т.
Поэтому, можно принять:
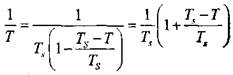
|
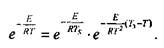
|
и что
(3.18)
(3.19)
Глава 3. Возникновение процессов горения
Подставляя (3.19) в (3.15), интегрируя и принимая во внимание, что
(dT\ -ппри критических условиях зажигания выполняется условие ~rz \ст - и s
получим:
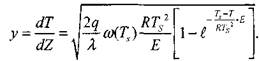
|
(3.20)
Эксперимент показывает, что величина
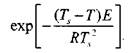
|
при изменении Ts— T на десятки градусов меняется в узких пределах: от 1 до 0,4. Следовательно, значение у вне зоны  незначительно отличается от величины
незначительно отличается от величины
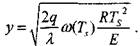
|
Таким образом, тепловой поток из зоны реакции будет равен:
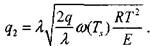
|
(3.21)
Величину этого теплового потока при установившемся состоянии можно представить в упрощенном виде:
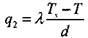
|
(3.22)
Отсюда следует, что при стационарном режиме выполняется следующее равенство:
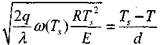
|
(3.23)
Корольченко А.Я. Процессы горения и взрыва
Соотношение (3.23) устанавливает зависимость критических величин и условий, при которых реализуется зажигание,от размеровсосуда.
Зажигание искрой горючей смеси представляет собой более сложное явление, чем зажигание нагретым телом. В искре происходит интенсивное местное возбуждение молекул и их ионизация. Одновременно искра в зоне своего действия вызывает сильное повышение температуры газа. В упрощенном виде искру можно представить как накаленное газообразное тело.
При зажигании искрой для каждой горючей смеси существует некоторая минимальная мощность искры, при которой смесь воспламеняется. Эта мощность зависит от состава смеси, давления и температуры. Характер этой зависимости от состава смеси показан на рис. 3.4. Он одинаков для всех горючих газов и паров. Наименьшая величина энергии требуется для зажигания смесей стехиометрического состава. Эта величина называется минимальной энергией зажигания. Значения минимальной энергии зажигания для некоторых газов приведеныв табл. 3.1.
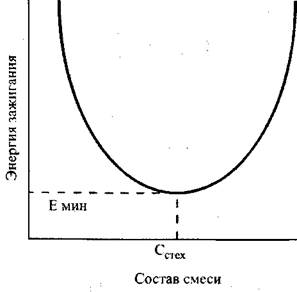
Рис. 3.4. Зависимость энергии зажигания от состава смеси Cстех - стехиометрический состав; Емин - минимальная энергия зажигания
Глава 3. Возникновение процессов горения
Таблица 3.1 Минимальная энергия зажигания
| Вещество | Емин, мДж |
| Метан | 0,28 |
| Этан | 0,24 |
| Пропан | 0,25 |
| Бутан | 0,25 |
| Гексан | 0,25 |
| Аммиак | |
| Этилен | 0,12 |
| Водород | 0,017 |
3.3. Самовозгорание
Процесс самовозгорания принципиально не отличается от процесса самовоспламенения. Оба этих процесса характеризуются одинаковыми закономерностями возникновения и развития.
Разделение этих процессов условно. Оно основано на величине температуры начала их развития. Если процесс возникновения горения в отсутствие внешнего источника начинается при температуре выше 100 °С, его обычно называют самовоспламенением, если при температуре ниже 100 °С - самовозгоранием.
Самовозгораться могут вещества в различном агрегатном состоянии: газы, жидкости и твердые. Самовозгорающиеся при нормальной температуре газы называются пирофорными.
Если температура реагирующей системы меньше температуры окружающей среды, то для развития процесса самовозгорания необходимо наличие прогрева, протекающего в четыре стадии (рис. 3.5):
1. Прогрев системы от внешнего источника тепла в результате теплообмена с окружающей средой. Выделением тепла за счет химической реакции на этой стадии пренебрегается.
2. Прогрев вещества за счет внешнего и внутреннего источника. Внутренним источником является тепло от начавшейся химической реакции.
3. Саморазогрев системы за счет химической реакции с теплопоте-рями в окружающую среду.
4. Адиабатический саморазогрев системы.
Корольченко А.Я. Процессы горения и взрыва
Анализ этих стадий наиболее удобно выполнить по схеме, разработанной профессором В. И. Горшковым, введя безразмерные переменные температуры 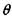
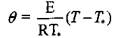
|
(3.24)
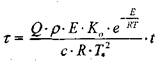
|
и времени 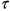
(3.25)
где Т* - температура в точке касания кривых тепловыделения и теплоот-вода по диаграмме Семенова (рис. 3.1, точка С) ; Т - текущая температура; Q - тепловой эффект реакции, Дж/кт*К; р - плотность материала, кг/м3; К0 - предэкспоненциальный множитель, 1/с; С - теплоемкость материала, дж/кг К; t - текущее время, с.
Рис. 5.5. Изменение температуры системы при наличии стадии прогрева (точками отмечены границы стадий)
Глава 3. Возникновение процессов горения
Схема профессора В. И. Горшкова предполагает оценку периода индукции - промежутка времени от начала процесса до самовозгорания. Период индукции представляет собой сумму времен 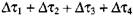 (рис. 3.5). Общее выражение для периода индукции имеет вид:
(рис. 3.5). Общее выражение для периода индукции имеет вид:
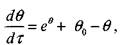 (3.26)
(3.26)
где 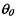 - безразмерная температура окружающей среды
- безразмерная температура окружающей среды
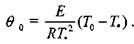
Для стадии прогрева 1 при отсутствии химической реакции в соответствии с формулой (3.26) можно записать
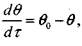 . , (3.27)
. , (3.27)
интегрирование которого с учетом начальных условий 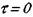 и
и 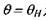 цает:
цает:
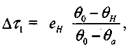 (3.28)
(3.28)
где 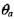 -ч неизвестная пока температура в точке
-ч неизвестная пока температура в точке 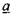 на диаграмме -рис. 3.5.
на диаграмме -рис. 3.5.
Для расчета времени прогрева системы на стадии 2 экспоненту (уравнение 3.26) нужно разложить в ряд в окрестности точки 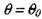 и, ог-
и, ог-
раничившись линейной частью ряда, получить
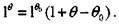 (3.29)
(3.29)
При подстановке соотношения (3.29) в формулу (3.26) имеем
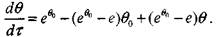 (3.30)
(3.30)
Корольченко А.Я. Процессы горения и взрыва
Для определения неизвестных значений температур на границах стадий учтем, что на границах этих участков равны не только температуры вещества, но и их производные по времени. Поэтому с учетом уравнений (3.27) и (3.30), для точки а справедливо соотношение
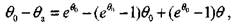 (3.31)
(3.31)
откуда 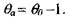
Для Ахь подставив формулу (3.31) в уравнение (3.28), получим:
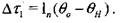 (3.32)
(3.32)
Путем интегрирования уравнения (3.30) найдем время задержки воспламенения на втором участке:
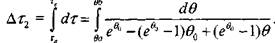
|
(3.33)
Решение уравнения (3.30) с учетом, что 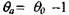 (см. формулу
(см. формулу
3.31), получаем:
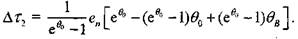 (3.34)
(3.34)
Время задержки самовозгорания на участке 3 можно определить методом разложения экспоненты в ряд в окрестности точки 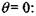
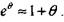 (3.35)
(3.35)
Уравнение (3.26) может быть представлено в виде:
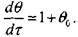 (3.36)
(3.36)
Поскольку левые части уравнений (3.36) и (3.30). равны, то, приравнивая правые части, определим температуру в точке в:
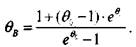 (3.37)
(3.37)
Глава 3. Возникновение процессов горения
. Из формул (3.34) и (3.37) найдем время, затрачиваемое реакцией на преодоление участка 2:
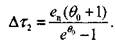
|
(3.38)
На участке 4, в условиях адиабатического разогрева вещества, экспоненту разложим в ряд Тейлора в окрестности точки 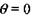 и ограничимся тремя первыми членами разложения:
и ограничимся тремя первыми членами разложения:
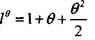 (3.39)
(3.39)
С учетом адиабатичности процесса теплоотдачей в окружающую среду при рассмотрении этого участка можно пренебречь и принять в формуле (3.26) 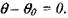
Тогда, в соответствии с формулами (3.26) и (3.39) получаем:
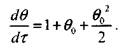
|
(3.40)
Поскольку в точке 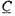 производные по температуре равны, приравняв уравнения (3.36) и (3.40), имеем:
производные по температуре равны, приравняв уравнения (3.36) и (3.40), имеем:
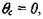 (3.41) и, соответственно, время на участке 3 равно:
(3.41) и, соответственно, время на участке 3 равно:
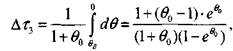
|
(3.42)
поскольку 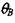 определяется соотношением (3.37).
определяется соотношением (3.37).
Интегрирование уравнения (3.40) позволяет оценить время адиабатического разогрева:
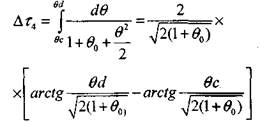
|
(3.43);:
На участке 4 происходит неограниченное возрастание скорости реакции. Поэтому в качестве верхнего предела интегрирования можно при-
Корольченко А.Я. Процессы горения и взрыва
нять бесконечность. С учетом этого обстоятельства и приняв во внимание, что на рассматриваемом участке 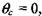 получаем:
получаем:
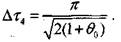 (3-44) Период индукции теплового самовозгорания получим как сумму
(3-44) Период индукции теплового самовозгорания получим как сумму
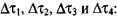
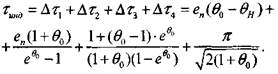 (3.45)
(3.45)
Формула (3.45) применима для условий:
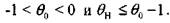
В качестве причин, приводящих к самовозгоранию, могут быть: внешний нагрев, теплота реакции окисления, тепловой эффект экзотермической реакции, микробиологический процесс. В соответствии с этим различают:
• тепловое самовозгорание,
• химическое самовозгорание,
• микробиологическое самовозгорание.
Тепловое самовозгорание.Характерно для дисперсных материалов. Известно, что многие дисперсные материалы реагируют с кислородом воздуха уже при обычной температуре. В условиях, благоприятствующих накоплению тепла в массе материала, происходит повышение его температуры. Это, в свою очередь, повышает скорость реакции окисления и может привести к самовозгоранию дисперсного материала.
Тепловое самовозгорание - физико-химический процесс, скорость которого зависит от скорости химической реакции, поступления кислорода к реагирующей поверхности и от интенсивности теплообмена самонагревающегося материала с внешней средой.
Дисперсные материалы имеют четкую границу соприкосновения с окружающей средой. По этой границе воздух проникает между частицами внутрь массы материала. Кислород, попадая в поры частиц или волокон дисперсного материала, адсорбируется в поверхностном слое.,
Глава 3. Возникновение процессов горения
Многие твердые вещества содержат в своем составе химически связанный кислород (например, нитросоединения, нитрозосоединения, высшие спирты, кислоты и т. д.), который при определенных условиях также может принимать участие в процессе окисления. Наличие развитой поверхности твердого материала с адсорбированным на ней кислородом -необходимое условие для начала теплового самовозгорания.
Если в процессе самонагревания вещество плавится, тем самым, сокращая свою удельную поверхность, самонагревание может прекратиться. В то же время, если сплав вещества попадает на развитую поверхность негорючего материала, развитие процесса самовозгорания может интенсифицироваться.
Гетерогенный процесс взаимодействия вещества с кислородом происходит на поверхности частиц в диффузионном или кинетическом режиме. Если общее время процесса превышает время химического превращения, то реализуется диффузионный режим, то есть скорость процесса определяется законами диффузионной кинетики.
В кинетическом режиме скорость окисления практически не зависит от притока кислорода извне. Процесс поддерживается вступающим в реакцию кислородом, который адсорбирован на поверхности частиц. В этом режиме может быть достигнута температура, при которой начинается тление материала. Известно, что тление многих органических материалов возможно при очень низких концентрациях кислорода в окружающем воздухе (3-5% об.).
Существенную роль в развитии процесса самовозгорания играет пористость материала. Воздух, заполняющий пространство между частицами материала и адсорбированный в порах, участвует в самонагревании. В результате диффузии он поступает к реагирующей поверхности. Поэтому наиболее склонны к тепловому самовозгоранию материалы, обладающие большой пористостью и структурой, обеспечивающей проникновение кислорода в зону реакции. Склонность к самовозгоранию увеличивается при повышении адсорбционной способности материала.
Самонагревающаяся масса твердого материала имеет неоднородное температурное поле вследствие различных условий теплоотвода: центральные зоны объема нагреваются до более высоких температур, чем поверхностные. В свою очередь высокая температура интенсифицирует экзотермические реакции окисления, протекающие в массе материала, повышая общую скорость процесса.
Корольченко А.Я. Процессы горения и взрыва __
На начальном этапе самовозгорания для многих материалов характерно сохранение внешнего вида, хотя во внутренней части происходит интенсивное обугливание. Затем на обугленной поверхности развивается процесс тления, который может перейти в пламенное горение. Поскольку промежуточным продуктом при самовозгорании большинства органических материалов является уголь, закономерности его самовозгорания оказывают существенное влияние на процесс в целом. Значительную роль в самовозгорании углей играет их способность адсорбировать на начальной стадии процесса пары влаги из окружающего воздуха. Установлено, что в результате адсорбции паров воды материал может нагреться до температуры 65-70°С (при поглощении 0,01 г влаги выделяется 22,6 Дж тепла).
Химическое самовозгорание.Ускорению процесса самовозгорания способствуют такие факторы, как повышенная аккумуляция тепла, развитая поверхность материала и его легкая воспламеняемость. Особую роль эти факторы играют при химическом самовозгорании. Известно, что скорость химических реакций, как правило, резко возрастает с увеличением температуры. Это обстоятельство имеет большое значение при химическом самовозгорании. Поскольку процессы окисления экзотермичны, в условиях затрудненного теплоотвода выделяющееся тепло идет на нагрев массы материала, ускоряя тем самым достижение критических условий самовозгорания.
Дисперсные материалы обладают всеми свойствами, которые благоприятно влияют на развитие самовозгорания и поэтому самовозгорание, вызванное контактом дисперсных материалов с различными веществами, достаточно часто служит причиной возникновения пожаров.
Известно, что хлопок склонен к самовозгоранию. Присутствие в хлопке различных веществ, как показали исследования профессора А. Н. Баратова, способствуют ускорению процесса. Ниже приведена продолжительность периода до самовозгорания хлопка, пропитанного хлопковым маслом с различными добавками:
| ДОБАВКА | ВРЕМЯ ДО САМОВОЗГОРАНИЯ, ЧАС |
| Хлопковое масло без добавок | 8-10 |
| Добавки: | |
| Крон желтый | |
| Сурик | |
| Редоксайд | 3,5-4 |
Глава 3. Возникновение процессов горения
| Ультрамарин | |
| Сажа газовая | 11,5 |
| Литопон | |
| Мел | |
| Сажа ламповая | 3,75 |
Самовозгорание развивается в результате присутствия в веществе примесей. Например, чистая аммиачная селитра не проявляет склонности к самовозгоранию. Температура ее разложения находится в пределах 468-478К. Однако, смеси аммиачной селитры с горючими органическими материалами (древесиной, льном, торфом и др.) склонны к самовозгоранию, что определяется возможностью протекания экзотермических реакций нитрования. В присутствии органических веществ при' температуре порядка 370К за счет тепла реакции нитрования начинается автокаталитическое разложение аммиачной селитры, в результате которого смесь самовозгорается. Катализаторами экзотермического разложения аммиачной селитры являются также примеси порошкообразных металлов.
Микробиологическое самовозгорание.Этот вид самовозгорания характерен для органических дисперсных и волокнистых материалов, внутри которых возможна жизнедеятельность микроорганизмов. Начальное самонагревание органического материала происходит за счет тепла, выделяемого микроорганизмами. Вызванное этим процессом повышение температуры обеспечивает ускорение экзотермической реакции, которая может закончиться возникновением тления (а затем и пламенного горения) в самой нагретой части объема.
Причиной выделения тепла при хранении продуктов растительного происхождения (зерна, сена, семян масленичных культур) является поглощение кислорода воздуха грибками и бактериями, которые присутствуют в этих материалах и интенсивно размножаются во влажной среде.
Повышение температуры, связанное с биологической активностью микроорганизмов, обусловлено разностью между скоростью вьщеления тепла и теплоотводом. Зафиксированы две стадии жизнедеятельности микроорганизмов, разделенные между собой некоторым промежутком времени. Первая стадия завершается при температуре 40-45°С. В процессе ее протекания выделение тепла происходит за счет жизнедеятельности так называемых лизофиль-ных организмов (в основном грибков), которые погибают при температуре 45-50°С. Вторая стадия, завершающаяся при 75-85°С, характеризуется жизнедея-
Корольченко А.Я. Процессы горения и взрыва_________________________
тельностью термофильных организмов (в основном бактерий). Обычно эти два типа микроорганизмов развиваются одновременно и являются ответственными за процессы самонагревания растительных материалов. На процессы самонагревания решающее влияние оказывают два фактора: размер популяции микроорганизмов и влагосодержание органического материала.
При температуре 85-88°С жизнедеятельность микроорганизмов прекращается; они погибают, а накопленное в системе тепло при определенных условиях может привести к дальнейшему развитию процесса самовозгорания.
Математическая модель процесса самонагревания насыпи растительного материала.Насыпь растительного материала является дисперсной средой с низкими коэффициентами теплопроводности и температуропроводности. Поэтому при активизации микробиологических процессов в какой-либо части насыпи выделяемое тепло задерживается в ней и возникает очаг повышенной тепловой активности. Распространение тепла в дисперсной насыпи осуществляется путем теплопередачи, в основном за счет теплопроводности. Для нахождения поля температур в растительном сырье требуется применение уравнений тепло- и влагопереноса, которые решаются совместно. Однако в рассматриваемом интервале температур (до 100 °С) перенос пара мал, и кажущаяся теплопроводность не зависит от влагосодержания. Можно принять также, что термические характеристики материала постоянны и равны во всех направлениях в силу изотропности свойств дисперсной массы. Таким образом, нахождение поля температур в насыпи сводится к решению уравнения теплопроводности с постоянными коэффициентами с внутренним источником тепловыделения.
При всем многообразии форм очагов самонагревания можно выделить две основные: пластовый очаг в виде пласта толщины 2R и гнездовой очаг в виде шара радиуса R.
Пластовый очаг.Задача распространения тепла в насыпи путем теплопроводности в случае пластового очага может быть сформулирована следующим образом: в неограниченной среде с начальной температурой Т0 в момент времени t=0 начинает действовать плоский источник тепловыделения, удельная интенсивность которого является непрерывной функцией координаты q=q(x). Рассмотрим задачу определения температурных полей в дисперсной насыпи комбикормового сырья, которая решается численно и аналитически для разных значений переменных, характеризующих объект исследования: плотности р, удельной теплоемкости с, ко-
Глава 3. Возникновение процессов горения
эффициента теплопроводности 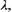 начальной температуры Т0, размера оча
начальной температуры Т0, размера оча
га R, его удельной мощности в центре q0 и на периферии 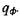 Теория подо
Теория подо
бия позволяет получить решение задачи, носящее обобщенный характер.
Применяя теорию обобщенных переменных, осуществим переход к без
размерным величинам: числу Фурье Т0, безразмерной температуре 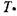 , от
, от
носительному расстоянию х* '
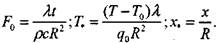 (3.46)
(3.46)
Тогда математическая формула задачи имеет вид:
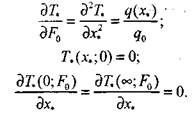
|
(3..47)
(3.48)
(3.49)
Применяя косинус-преобразование Фурье, получим дифференциальное уравнение
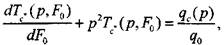 (3.50)
(3.50)
где 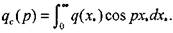 (3.51)
(3.51)
Решением уравнения (3.50) при условии (3.48) является выражение
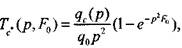 (3.52) оригинал которого имеет вид
(3.52) оригинал которого имеет вид
(3.53)
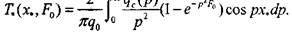
В насыпи комбикормов распределение микрофлоры имеет случайный характер и удельную интенсивность тепловыделения можно представить в виде
(3.54)
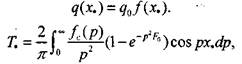 (3.55) где
(3.55) где 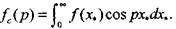 (3.56)
(3.56)
Корольченко А.Я. Процессы горения и взрыва
Разлагая экспоненту в ряд получим:
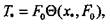 (3.57)
(3.57)
где
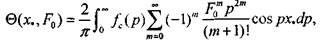 (3.58)
(3.58)
Решение (3.56) совпадает с решением задачи на охлаждение греющейся пластины в неограниченной среде в случае одинаковости теплофи-зических характеристик и начальных температур пластины и среды. Подставляя (3.46) в (3.56), получим решение в случае отсутствия фонового тепловыделения 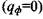
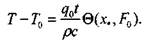 (3.59)
(3.59)
В стационарном случае наличия равномерного фонового разогрева с удельной мощностью 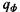 справедливо соотношение
справедливо соотношение
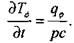
|
(3.60)
Применяя принцип суперпозиции тепловых полей, получаем приближенную формулу для расчета распределения температуры в дисперсной насыпи при наличии фонового тепловыделения
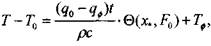 (3.61)
(3.61)
где 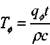 согласно (3.60).
согласно (3.60).
Расчет безразмерной относительной температуры 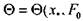 ) вы-
) вы-
полнен путем численного интегрирования уравнения (3.47) с начальным условием (3.48) и граничными условиями (3.49) для значений числа Фурье 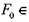 [0,05; 8] и относительного расстояния
[0,05; 8] и относительного расстояния 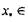 [0; 15]. т.е. в области значе-
[0; 15]. т.е. в области значе-
ний параметров, имеющей практический интерес. Значения 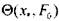 вычис-
вычис-
лялись согласно (3.56) для случая 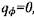 , что не меняет общности полч-ченных
, что не меняет общности полч-ченных
результатов. В результате расчета построена номограмма 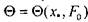 представленная на рис. 3.6, позволяющая определить температурное поле в дисперсной насыпи комбикормового сырья путем использования соотношения (3.61). На рис.3.7 представлены расчетные кривые распределения температур в насыпи травяной муки, полученные по формуле (3.61) при различных параметрах очага. На рис.3.8 приведена номограмма изменения темпе-
представленная на рис. 3.6, позволяющая определить температурное поле в дисперсной насыпи комбикормового сырья путем использования соотношения (3.61). На рис.3.7 представлены расчетные кривые распределения температур в насыпи травяной муки, полученные по формуле (3.61) при различных параметрах очага. На рис.3.8 приведена номограмма изменения темпе-
Глава 3. Возникновение процессов горения
ратуры в центре очага до пожароопасного значения (-100 °С) в зависимости от времени для разной интенсивности тепловыделения.
|
Рис. 3.6. Номограмма безразмерной относительной температуры для пластового очага (Fo ~ число Фурье).
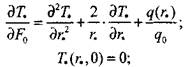
|
| (3.62) (3.63) (3.64) |
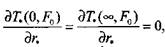
|
Гнездовый очаг.Задача нахождения температурных полей в случае гнездового очага сводится к решению симметричной задачи, которая в обобщенных переменных имеет вид:
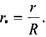
|
где относительная координата
Корольченко А.Я. Процессы горения и взрыва
|
Рис. 3.7. Температурные кривые при различных параметрах очаги для травяной муки (характеристики материала:
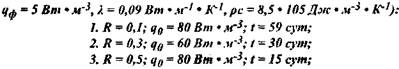
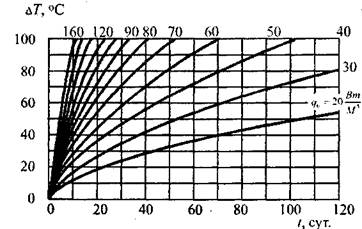
Рис. 3.8. Рост температуры в центре пластового очага (R~0,3m.) прирахшчной интенсивности тепловыдаения (шроты, жмыхи).
Глава 3. Возникновение процессов горения
Задача решается численно совместно с уравнением
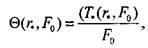
|
(3.65)
в результате чего построена номограмма  ) для практически
) для практически
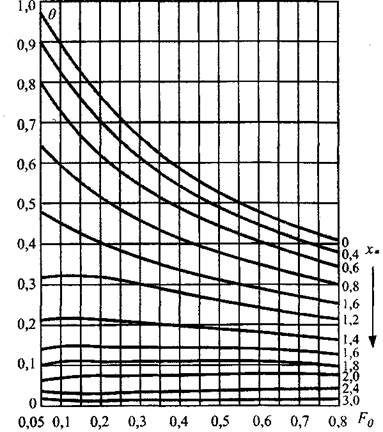
важных значений параметров, позволяющая по формуле (3.61) определять распределение температур (рис. 3.9).
Предложенная математическая модель процесса самонагревания удовлетворительно согласуется с экспериментом. Так, на рис. 3.10 представлены расчетные кривые и экспериментальные значения температур, полученные в
|
Рис. 3.9. Номограмма безразмерной относительной температуры для гнездового очага (Fo - число Фурье).
Корольченко А.Я. Процессы горения и взрыва
крупномасштабном эксперименте на фрагменте силоса размером 3x3x4,8 м. Некоторая ассиметрия температурных полей относительно плоскости х=0, соответствующей центру очага, связана с конвекцией нагретых паров воды и воздуха в верхнюю часть насыпи.
Адекватность модели эксперименту позволяет использовать ее для решения целого ряда прикладных задач: расчета радиуса чувствительности термодатчика, оценки эффективности система термоконтроля, расчета пожароопасности темпа роста температуры и пожаробезопасных сроков хранения сырья.
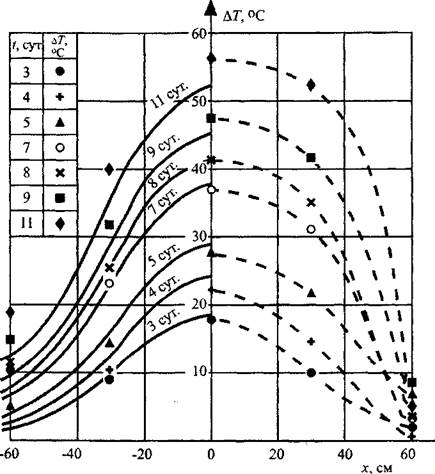
Рис. 3.10. Температурные поля при пластовом самонагревании травяной муки (крупномасштабный эксперемент): р*=470кг* м-3; R = 0,25 м; q0 = 75 Вт 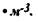
Глава 3. Возникновение процессов горения
Приближенное решение задачи самовозгорания дисперсных материалов для реакции порядка 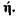 Самовозгорание мелкодисперсных органических материалов относится к одному из распространенных явлений, наблюдаемых в практике хранения, переработки и транспортировки веществ и материалов. Особенностью самовозгорания является то, что оно для своего появления и развития не требует внешнего импульса, инициирующего горение, или высоких температур. Это явление возникает за счет реакции гетерогенного окисления в больших объемах продукта при относительно низких температурах окружающей среды и сопровождается образованием газообразных продуктов реакции. Из-за плохой теплопроводности массы мелкодисперсного продукта происходит накопление тепла в объеме, возрастание температуры, скорости химической реакции и, в конечном счете, воспламенение материала.
Самовозгорание мелкодисперсных органических материалов относится к одному из распространенных явлений, наблюдаемых в практике хранения, переработки и транспортировки веществ и материалов. Особенностью самовозгорания является то, что оно для своего появления и развития не требует внешнего импульса, инициирующего горение, или высоких температур. Это явление возникает за счет реакции гетерогенного окисления в больших объемах продукта при относительно низких температурах окружающей среды и сопровождается образованием газообразных продуктов реакции. Из-за плохой теплопроводности массы мелкодисперсного продукта происходит накопление тепла в объеме, возрастание температуры, скорости химической реакции и, в конечном счете, воспламенение материала.
Практический интерес к процессам теплового взрыва обусловлен принципиальной возможностью заранее вычислить безопасные условия проведения переработки и хранения дисперсных материалов, при которых исключается самопроизвольное возникновение горения.
Математическая постановка задачи о тепловом взрыве в классической теории заключается в следующем: задается область (объем), внутри которой находится реагирующее вещество. Считаются известными физико-химические константы, характеризующие теплообмен и реакцию горения, механизм теплоотдачи внутри области, начальные и граничные условия.
Решение приближенной задачи определения условий самовозгорания дисперсных материалов при их окислении по реакции порядка 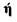 и изменении в широком диапазоне параметров тепломассообмена сводится к известным уравнениям теплопроводности с распределенным источником тепла и скорости химической реакции
и изменении в широком диапазоне параметров тепломассообмена сводится к известным уравнениям теплопроводности с распределенным источником тепла и скорости химической реакции
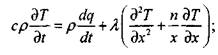
|
(3.66)
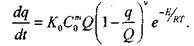
|
(3.67)
Граничными и начальными условиями будут
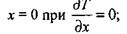
|
(3.68)
Корольченко А.Я. Процессы горения и взрыва
(3.69)
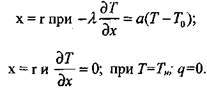 (3.70)
(3.70)
Уравнение (3.66) является уравнением теплопроводности с распределенными источниками тепла в насыпи материала, а уравнение (3.67) характеризует скорость химической реакции. Граничные условия формулируют отсутствие теплового потока на оси симметрии рассматриваемых объемов и теплообмен с окружающей средой по закону Ньютона. В задаче рассматриваются три симметричные области: плоскопараллельная (п = 0); цилиндрическая (п = 1); сферическая (п - 2), и приняты следующие обозначения: Тн, Т0, Т - начальная температура, температура окружающей среды и текущая температура в зоне реакции, соответственно; х,r - текущая координата и характерный размер, соответственно; t - время; Q ~ тепловой эффект реакции; Е - энергия активации; К0 - прсдэкспонент;
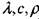 ' - теплопроводность, теплоемкость и плотность вещества, соответственно; а - коэффициент теплоотдачи; R - газовая постоянная; С0 - концентрация окислителя в окружающей среде; q - количество тепла, выделяющегося в ходе реакции на единицу массы твердой фазы: т,
' - теплопроводность, теплоемкость и плотность вещества, соответственно; а - коэффициент теплоотдачи; R - газовая постоянная; С0 - концентрация окислителя в окружающей среде; q - количество тепла, выделяющегося в ходе реакции на единицу массы твердой фазы: т, 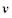 - порядок реакции по окислителю и горючему; а - коэффициент теплоотдачи.
- порядок реакции по окислителю и горючему; а - коэффициент теплоотдачи.
Определим среднюю по объему температуру
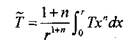 (3.71)
(3.71)
и приближенно учтем распределение температуры в виде параболы второго порядка где А и В - коэффициенты являющиеся функцией времени, которые определяются из граничных условий (3.68)-(3.70). Тогда средняя температура будет
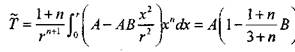
|
(3.72)
Выразим уравнение (3.66) и (3.67) через среднюю температуру, для чего все члены этих уравнений умножим на x"»dx и проинтегрируем от 0 до оо
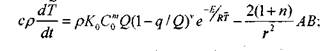
|
(3.73)
Глава 3. Возникновениепроцессов горения
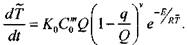
|
(3.74)
Определим произведение АВ через среднюю температуру 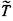 . Из (3.69) и (3.99) найдем
. Из (3.69) и (3.99) найдем
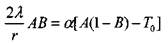
|
(3.75)
Преобразуем (3.72) к виду
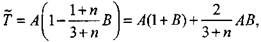
|
(3.76)
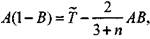
|
получим, что
(3.77)
Подставляя (3.77) в (3.75) найдем, что
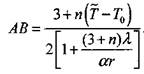
|
(3.78)
С учетом (3.78)и равенства критерия 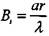 система уравнений
система уравнений
(3.66) и (3.67) перепишется в виде (знак осреднения опускаем)
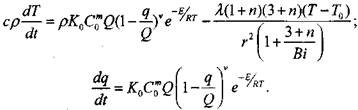
|
(3.79)
(3.80)
Для того,чтобы свести полученную систему уравнений к нашей задаче, преобразуем выражение 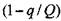 в экспоненту
в экспоненту
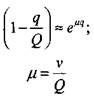
|
где
(3.81)
(3.82)
Корольченко А.Я. Процессы горения и взрыва
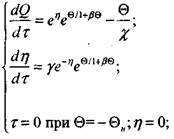
|
В безразмерных переменных (3.66) и (3.67) с учетом (3.81) перепишется в виде
(3.83)
где
(3.84)
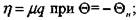
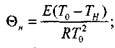
|
(3.85)
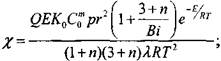
|
(3.86)
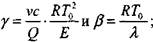
|
(3.87)
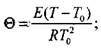
|
(3.88)
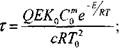
|
(3.89)
Полученная система уравнений определяет критическое условие самовозгорания:
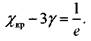
С учетом принятых обозначений можно записать
(3.90)
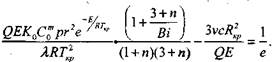
|
(3.91)
Глава 3. Возникновение процессов горения
Полученное критическое условие отличается членом
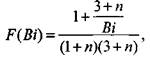
|
(3.92)
который учитывает неоднородность распределения температуры в оо-разце.
Анализ уравнения (3.92) показывает, что оно дает несколько завышенные значения по сравнению с решением Франк-Каменецкого. Введением в уравнение (3.92) согласующей функции Ф(Вi) (рис.3.11),
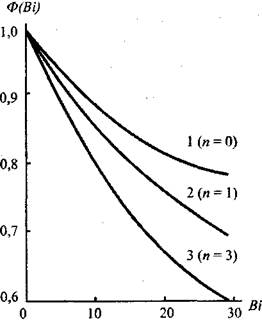
Рис 3.11. Зависимость функции Ф(Bi) от Вi: 1 - плита, 2 - циллиндр, 3 - сфера
значения которой рассчитаны по экспериментальным данным, достигается удовлетворительное согласие с решением задачи Франк-Каменецкого во всем диапазоне изменения параметра Вi (от 0 до со)
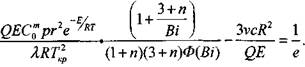
|
(3.93)
Корольченко А.Я. Процессы горения и взрыва
Таблица 3.2
Дата добавления: 2015-09-29; просмотров: 2016;
