Окислительное декарбоксилирование пирувата
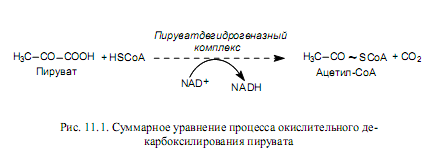
Как показано ранее (глава 9), основным продуктом катаболизма углеводов является пируват. Это трехуглеродное соединение образуется также при окислении многих аминокислот. Для того чтобы пируват мог подвергнуться дальнейшему окислению в ЦТК, он должен быть превращен в ацетил-СоА. Этот весьма сложный процесс осуществляется с участием пируватдегидрогеназного комплекса, который включает три фермента и пять кофакторов. Суммарное уравнение процесса окислительного декарбоксилирования пирувата выглядит довольно просто (рис. 11.1), однако механизм действия всех компонентов пируватдегидрогеназного комплекса включает несколько стадий.
На первой стадии пируватдекарбоксилаза (называется также дегидрогеназой) с помощью своего кофактора — тиаминдифосфата катализирует декарбоксилирование пирувата с образованием оксиэтильного производного (—СНОН—СН3), которое остается связанным с кофактором и ферментом. Затем происходит перенос оксиэтильного остатка на молеку-
лу липоевой кислоты, которая служит кофактором второго фермента комплекса — липоат-ацетилтрансферазы. Перенос завершается окислением оксиэтильного остатка до ацетильной группы и частичным восстановлением липоевой кислоты. На третьей стадии ацетильная группа переносится от липоевой кислоты на тиоловую группу коэнзима А, в результате чего ацетил-СоА отделяется от комплекса и образуется полностью восстановленная форма липоевой кислоты — дигидролипоевая кислота. Последняя стадия процесса катализируется третьим ферментом—дигидролипоилдегидрогеназой, содержащей FAD в качестве простетической группы. Этот фермент катализирует окисление дигидролипоевой кислоты в липоевую с восстановлением FAD до FADH2 . Наконец, восстановительные эквиваленты от FADH2 передаются на NAD+, который транспортирует их в дыхательную цепь.
Следует отметить, что в составе сформированного в процессе окислительного декарбоксилирования пирувата продукта — ацетил-СоА —появляется макроэргическая связь (обозначена волнистой линией на рис. 11.1).
Активность пируватдегидрогеназного комплекса зависит от количества АТР в клетке и регулируется с привлечением механизма ферментативной модификации белка: АТР-зависимая протеинкиназа осуществляет фосфорилирование определенных аминокислотных остатков в пируватдекарбоксилазной субъединице, в результате чего фермент утрачивает активность. Обратное действие (восстановление активности пируватдекарбоксилазы) совершает особая фосфатаза, которая дефосфорилирует белковую молекулу.
Дата добавления: 2015-09-29; просмотров: 1169;
