Физико-химические свойства природных газов. Расчет газовой смеси.
Газы делятся на природные и искусственные. В настоящее время для газоснабжения используются в основном природные газы. Они имеют сложный многокомпонентный состав. В зависимости от происхождения природные газы подразделяют на три группы:
1. Газы, добываемые из чисто газовых месторождений, на 82. ..98 % состоящие из метана;
2. Газы газоконденсатных месторождений, содержащие 80.. .95 % метана;
3. Газы нефтяных месторождений (попутные нефтяные газы), содержащие 30...70 % метана и значительное количество тяжелых углеводородов. Газы с содержанием тяжелых углеводородов (от пропана и выше) менее 50 г/м3 принято называть сухими или «тощими», а с большим содержанием углеводородов - «жирными».
В последнее время часто начали говорить о четвертой группе природных газов – о сланцевом газе и о метане из угольных пластов. Сланцевый газ - природный газ, добываемый из сланца, состоящий преимущественно из метана. Сланцевый газ образуется в результате деградации керогена, который содержится в горючих сланцах; газ находится там в микротрещинах. Масштабное промышленное производство сланцевого газа было начато в США в начале 2000-х на месторождении Barnett Shale. Благодаря резкому росту его добычи, названному в СМИ «газовой революцией», в 2009 году США стали мировым лидером добычи газа, Причём более 40 % приходилось на нетрадиционные источники (метан из угольных пластов и сланцевый газ). Метан угольных пластов содержится в угленосных отложениях. Является причиной взрывов в угольных шахтах. Метан угольных пластов - экологически более чистое, чем уголь, и эффективное топливо.
Природные газы без цвета, без запаха и в нормальном состоянии они бывают в разных агрегатных состояниях. Метан, этан и этилен-газообразные, пропан, бутан, бутилен және пропилен - в виде паров жидкости, а под высоким давлениях - жидкие вещества. Тяжелые углеводороды, начиная с изопентана в нормальном состоянии - жидкости, они входят в состав бензиновой фракции. Для того, чтобы природные газы в целях безопастности имели запах, к ним специально добавляет специальные вещества – одоранты.
Обычно рассматривают газов в двух условиях:
1. Нормальное условие - Рн=0,1013 МПа (нормальное атмосферное давление), Tн=273,16K (00C);
2. Стандартное условие - Рст=0,1013 МПа (нормальное атмосферное давление), Tст=293,16K (200C – комнатная температура).
Для выполнения гидравлического и теплового расчета газопроводов и расчета режимов работы компрессорных станций необходимо знать основные свойства природных газов: плотность, вязкость, газовую постоянную, псевдокритические значения температуры и давления, теплоемкость, коэффициент теплопроводности, коэффициенты сжимаемости и Джоуля - Томсона.
Молярная масса газа (M), она есть масса 1 моля газа. Один моль вещества состоит примерно из 6 млрд. трлн. числа любых молекул (равной числу Авогадро: NA=6,02·1023). Ее размерность [M]= кг/моль, или [M]= г/моль. Молярная масса газа находится через его молекулярную массу. Например, молекулярная масса водорода приблизительно равна 2, тогда его молярная масса M≈2г/моль=2·10-3кг/моль. Для кислорода M≈32г/моль, для азота M≈28г/моль, для пропана (C3H8) M≈12·3+1·8=44г/моль, и т.д. Плотность газа есть масса единичного объема:
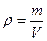 . (121)
. (121)
Относительная плотность газа по воздуху Δ есть отношение плотности газа к плотности воздуха. Для всех состояний газа имеет место выражение:
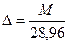 , (122)
, (122)
здесь [M]= г/моль, 28,96 г/моль – молярная масса воздуха. Для стандартного состояния
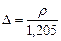 , (123)
, (123)
здесь ρ- плотность газа в стандартных условиях (плотность воздуха в стандартных условиях 1,205кг/м3, для нормальных условии 1,29кг/м3).
Любой газ в количестве 1 моль в нормальном состоянии занимает объем примерно 22,4·10-3 м3, поэтому плотность газа в нормальных условиях
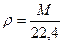 . (124)
. (124)
Здесь [M]= г/моль, но это выражение неверно для стандартного состояния.
Вязкость (динамическая) газа μ, а [μ]=Па·с. Вязкость газа определяется передачей импульса (из одного слоя в другой) молекулой газа при ее переходе из одного слоя течения в другой. Поэтому вязкость газа сильно зависит от температуры и почти не зависит от давления газа (до 4 МПа). Динамическая μ и кинематическая ν вязкости газа газа связана соотношением:
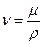 . (125)
. (125)
Удельная теплоемкость газа при постоянном давлении с, а [с]=Дж/(кг·К). Она равна количеству теплоты, необходимому для нагревания 1 кг газа на 1К при постоянном давлении. Давление газа Р показывает силу, действующей по нормали к единице площади стенки сосуда со стороны молекул газа. [Р]= атм, [Р]=Па , или [M]= МПа. 1 МПа= 106 Па≈10 Атм. Температура газа определяется по шкале Кельвин и Цельсий, они связаны соотношениями:
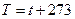 . (126)
. (126)
Во многих случаях при помощи сжатия газ можно превратить в жидкость. Однако температура газа должна быть ниже критической (Ткр). Если она равна или выше критической температуры, то ни в какой давлений газ не превращается в жидкость. А также, если давление газа равно или выше критического давления (Ркр), то в дальнейшем, ни в какой температуре газ не превращается в жидкость.
К основным видам транспорта газа принадлежат железнодорожный транспорт, морской транспорт и трубопроводный транспорт. Каждый вид транспорта имеет сильную и слабую сторону.
Для расчета газовой смеси необходимо знать уравнению состояния газа. Уравнение состояние газа связывает основные параметры газа, как его количество, объем, давление и температуру. Из школьного и высшего курса физики вам известны уравнения состояния Менделеева-Клапейрона, Ван-дер-Ваальса, а для газопроводов удобно уравнение состояние газа, записанное через сжимаемости газа:
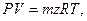 (127)
(127)
где R- постоянная газа, определенная для конкретного газа, или газовой смеси. Она находится через универсальную газовую постоянную (8,314Дж/(моль·К)):
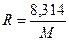 . (128)
. (128)
единицы измерения в выражении (8): [m]= кг, [M]= кг/моль, ([Р]= Па). z в выражении (128) называется сжимаемостью газа (коэффициент сжимаемости) для конкретного газа, или газовой смеси. Коэффициент сжимаемости зависит от состоянии газа. Он обычно определяется по специальным номограммам в зависимости от приведенных температур и давлений, либо в аналитическом виде по формуле, рекомендованной отраслевыми нормами проектирования 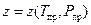 . Величины
. Величины 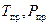 называются приведенными параметрами газа:
называются приведенными параметрами газа:
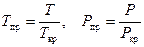 . (129)
. (129)
Коэффициент сжимаемости учитывает отклонение свойства природного газа от законов идеального газа. Есть 2 формулы, рекомендованной отраслевыми нормами проектирования для коэффициента сжимаемости. Но обе они приближенные и дают почти одинаковые результаты при реальных параметрах магистрального газопровода. Первая из формул:
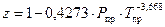 . (130)
. (130)
А другая формула такая:
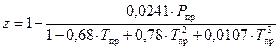 . (131)
. (131)
В этих формулах для магистрального газопровода берутся средние значения давлении и температуры:
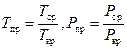 . (132)
. (132)
Для расчета удобна первая формула.
Обычно количество газовой смеси (или газа) передает через его объем. Но объем зависит от реального состояния газа, то есть, если для заданного состояния известно рабочий объем газа V, то в других состояниях соответствующие объемы газа будут другими. Для ясности объемы берутся для нормального и для стандартного условия. В технических расчетах, а в расчетах по хранению и транспортировке газа, а также в коммерческих расчетах объем газа приводится к стандартному условию.
Формула приведения рабочего объема газа к нормальному условию (нормальный объем) такая:
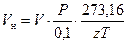 . (133)
. (133)
Формула приведения рабочего объема газа к стандартному условию (коммерческий объем):
 . (134)
. (134)
здесь [Р]= МПа.
Необходимые физико-химические свойства газовой смеси включают следующих параметров: молярная масса M, псевдокритическая температура Ткр, псевдокритическое давление Ркр, псевдокритический объем Vкр, удельная теплоемкость газа при постоянном давлении, динамическая вязкость 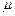 и коэффициент теплопроводности λ. Их определяют через свойств каждых компонентов смеси.
и коэффициент теплопроводности λ. Их определяют через свойств каждых компонентов смеси.
Состав газовой смеси характеризуется массовыми, или объемными, или молярными долями каждого компонента. Объемные доли каждого компонента смеси равны соответствующим молярным долям и с ними проще вести расчет. Пусть объемные доли каждого компонента смеси у1, у2, у3, и т.д. Тогда для всей газовой смеси всегда справедлива следующая формула:
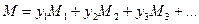 , (135)
, (135)
Остальные параметры смеси в различных источниках определяются по разному. Самый простой способ - способ определения по правилу аддитивности (пропорционального сложения). Этот способ просто в использовании, но не очень точный. Он используется при ориентировочных расчетах и дает очень неплохой результат, когда доля метана в составе смеси не менее 96% (особенно при расчете вязкости). И так:
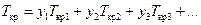 , (136)
, (136)
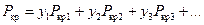 . (137)
. (137)
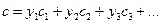 , (139)
, (139)
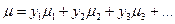 . (140)
. (140)
Самый часто используемый способ расчета газовой смеси для магистральных газопроводов - способ, когда расчет ведется при помощи уже известных параметров газовой смеси:
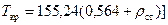 , (141)
, (141)
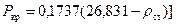 , (142)
, (142)
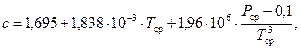 (143)
(143)
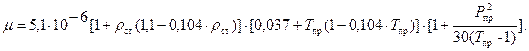 (144)
(144)
Здесь ρст- плотность газовой смеси в стандартных условиях ( 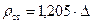 ),
),
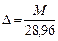 ,
,
- относительная плотность смеси, [M]= г/моль, 28,96 г/моль –молярная масса воздуха. 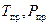 - приведенная температура и приведенное давление смеси, Tср- средняя интегральная температура в магистральном газопроводе. Здесь также находится коэффициент Джоуля-Томсона:
- приведенная температура и приведенное давление смеси, Tср- средняя интегральная температура в магистральном газопроводе. Здесь также находится коэффициент Джоуля-Томсона:
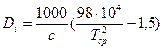 , (145)
, (145)
Единицы измерения: [с]=Дж/(кг∙К), [Di]=К/МПа.
В этих формулах средние значения давлении и температуры определяются по их начальными рн, Тн и конечным рк значениями в перегоне между КС и по температуре 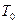 окружающей среды газопровода:
окружающей среды газопровода:
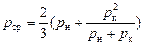 , (146)
, (146)
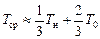 . (147)
. (147)
Нам думается, что раз при выводе формулу расхода считалось, что динамическая вязкость мало изменяется по длине газопровода (что она не зависит от давления), следовательно, число Рейнольдса также постоянно по всей длине перегона, то с такой же точностью можно предположить удовлетворительной применимости формул (136-140). Тем более на практике вводятся различные поправочные коэффициенты.
Дата добавления: 2015-09-28; просмотров: 3893;
