МАТЕРИАЛОВ. В своей жизни человек использует для удовлетворения своих потребностей большое количество продуктов
МАТЕРИАЛОВЕДЕНИЕ.
ТЕХНОЛОГИЯ КОНСТРУКЦИОННЫХ
МАТЕРИАЛОВ
В своей жизни человек использует для удовлетворения своих потребностей большое количество продуктов, изделий и т. д.
Все они производятся из различных материалов, основой которых являются разнообразные химические вещества и соединения.
Для производителя очень важно совокупное знание состава, химической связи, структуры и свойств этих веществ и материалов, а также закономерностей их изменения под воздействием окружающей среды и в процессе переработки, а именно при тепловых, механических, химических и других.
Эти сведения и дает изучение дисциплины «материаловедение». Это один из основных предметов, который определяет уровень подготовки специалистов инженерного профиля для любых отраслей промышленности и народного хозяйства. Его основным объектом является материал, а предметом – состав, тип связи, структура, свойства и применение этих материалов.
«Материал» и «материаловедение» являются производными от более широкого понятия «материя».
«Материя есть философская категория для обозначения объективной реальности, которая дана человеку в ощущениях его, которая копируется, фотографируется, отображается нашими ощущениями, существуя независимо от них». Материя - это объективная реальность, существующая вне нашего сознания, но отражаемая им, и характеризуемая массой и энергией.
Мы знаем, что материя всегда обладает определенной организацией и существует в виде конкретных материальных систем.
Согласно современным воззрениям естественные науки рассматривают материю как объективную существующую реальность вне нашего сознания, отражаемую им и характеризуемую массой и энергией. В зависимости от того, какая составляющая в характеристике материи преобладает, она существует в двух основных формах (поле и вещество). Масса и энергия, в свою очередь, определяют пространство, занимаемое конкретным видом материи и время его жизни в виде индивидуального уровня материи и вещества в зависимости от окружающих условий.
Поле – это материальное образование, связывающее между собой тела, передающие действия от одного к другому.
Поле - это форма существования материи, которая, прежде всего обладает энергией, а не массой, хотя и имеет последнюю. В результате важнейшим его свойством является непрерывность в пространстве.
Существуют следующие виды полей – магнитное, электрическое, гравитационное, электромагнитное и др.
Вещества – это все окружающие нас видимые или макроскопические тела. Вещество характеризуется, прежде всего собственной массой (покоя), а следовательно, дискретностью (прерывностью в пространстве) соответственно существует в виде индивидуальных частиц.
Под веществом в настоящее время понимают форму существования материи, прежде всего в виде дискретных частиц, имеющих собственную массу покоя. Понятие дискретности вещества предполагает возможность отдельного существования и рассмотрения разных уровней организации материи в виде различных по массе и размеру индивидуальных частиц.
В результате индивидуальным веществом является элементарная частица (элементарное вещество), атомная частица (атомное вещество), молекулярно-ковалентная, немолекулярная металлическая, ионная или смешанная частицы (в том числе молекулярное вещество) и, наконец, ассоциаты, агрегаты, англомераты и т. д. индивидуальных химических соединений (в том числе надмолекулярное вещество).
По уровню организации материи вещества подразделяют на физические, химические, биологические и т. д. Химические в свою очередь делятся на молекулярные и немолекулярные, металлические и неметаллические.
Схема усложнения частиц вещества может быть представлена в виде строго определенной последовательности основных уровней организации материи микромира:

| 1. Немолекулярные (металлические и ионные) | |||
 Элементарные
частицы → (кварки) Элементарные
частицы → (кварки)
| Атомные частицы → | Химические частицы | 2. Молекулярные → (ковалентные) | ассоциаты, агрегаты, конгломераты и т. д. |
Отсюда следует, что каждому уровню вещественной формы материи соответствует своя основная частица вещества. Причем в ряду: элементарная - атомная - химическая происходит их усложнение и переход количества составляющих частиц в новое качество на каждом уровне. Это выражается в специфике их природы, связи, структуры и свойств, то есть в проявлении индивидуальности частицы вещества любого структурного уровня. Так, химические частицы могут быть представлены уже тремя основными типами химических веществ в виде молекулярных частиц («атомы», в которых связаны преимущественно ковалентным типом связи), металлических немолекулярных агрегатов («атомы», в которых связаны преимущественно металлическим типом связи) и ионных немолекулярных агрегатов («атомы», в которых связаны преимущественно ионным типом связи) и их производными (химические радикалы, катионы, анионы, цвиттерионы и т. д.). Кавычки в термине «атом» говорят о том, что после образования химической частицы атом в составе ее структуры в виде индивидуальной частицы не существует, и химическое соединение представляет собой уже не просто атомную систему типа ядро - электронная оболочка, а более сложную и качественно новую (химическую) систему: ядро - обобществленные электроны - ядро.
На Земле мы имеем дело прежде всего с химическим веществом, как термодинамически наиболее устойчивой в н. у. вещественной формой материи в виде химического соединения. Кроме того, мы имеем дело и с агрегатами, ассоциатами и производными на их основе (типа конгломератов). Нo это лишь производные химического вещества, в котором последнее максимально сохраняет свою индивидуальность (в отличие от атомов, входящих в состав химических соединений и теряющих ее при этом).
Земная атмосфера или воздух состоит из химических соединений типа – кислород О2, водород Н2 и т. д.; земная кора на три четверти складывается из высокомолекулярных элементооксановых (то есть со связями элемент-кислород, где в качестве элемента обычно выступает кремний, алюминий, железо и т. д.) соединений и минералов на их основе, а остаток из ионных химических соединений; основой мирового океана, морей, рек, озер и т. д. является химическое соединение вода – Н2О и наконец, растительность Земли представляет собой в подавляющем числе случаев химическое полимерное вещество типа целлюлозы и ее производных.
При этом сам человек и животный мир Земли представляют собой биохимические объекты, фундаментальной основой структуры которых является химический уровень организации вещественной материи. Кроме того, процессы жизнедеятельности этих биохимических систем опираются на химические превращения одних химических соединений в другие как внутри организма, так и в процессе деятельности человека по своему жизнеобеспечению в процессе получения энергии, питания, материалов и т.д.
Человек в процессе своего существования и развития на Земле при осуществлении направленной деятельности (в том числе и научной) для своего жизнеобеспечения соприкасается в силу доступности и распространенности прежде всего с химическим уровнем строения вещества (химические соединения или вещества). Это воздух, вода, земная кора, минералы и т. д. и т. п.
В условиях Земли (н. у.) химическое соединение является наиболее естественным и распространенным видам вещественной материи, а его превращение - наиболее распространенной формой движения материи на Земле. И следовательно, химическое вещество является объективно основным вещественным видом материи на Земле.
Оба типа материи по своему строению и свойствам многообразны и неисчерпаемы. Грани между ними отчетливо видны лишь в видимом мире. В сфере микропроцессов данные границы относительны.
Материал это уже объект вещественной материи.
В научной литературе существует три варианта определения термина «материал»:
- это то, из чего можно что-либо сделать;
- это информация (сведения, факты и т. д.) о чем-либо, которая может быть использована с разной целью (написание статьи, книги и т. д.);
- это тканая материя (материал для одежды и т. д.).
Второе и третье определения достаточно узки и универсальны.
Первый вариант определения является философским и наиболее широким. В результате, под него попадают любые виды и формы вещества и материи в целом (независимо от того, являются ли они естественными или искусственными, то есть произведенными руками человека), из которых можно «построить» более высокие уровни строения материи и мироздания в целом.
В широком смысле слова материал - это любой вид (форма и уровень организации) материи, который может быть использован и употребляется природой или человеком (независимо друг от друга) для получения его производных. В более узком практическом смысле материал - это вид вещества, который наиболее востребован в науке, технике и быту для производства изделий и конструкций.
Осознанное понимание того, что наиболее практически важным и естественным в нормальных условиях материалом, определяющим особенности структуры, свойства и области применения металлов, керамик, бетонов, полимеров и т. д. является химическое вещество, позволяет еще более сузить и конкретизировать его определение: материал в нормальных (реальных) условиях - это, прежде всего, вид вещества, построенный на основе химических или смешанных типов связей, ядер атомных остовов, используемый на практике. Или ещё короче реально в условиях Земли материал - это любой вид химического соединения (химического вещества) и производных от него веществ (агрегаты, ассоциаты и т.д.).
В результате, проще говоря, в нормальных условиях Земли, материалом является тот вид вещества, из которого можно изготовить реальное изделие.
Материаловедение - это наука о связи состава и природы, а также типах взаимодействия элементов (химического, физического, механического и смешанного) составляющих материал со структурой и свойствами, определяющими области применения различных материалов.
Основной практической целью материаловедения является оптимизация состава, структуры, свойств материалов и методов их переработки с целью получения конкретных изделий с заданными эксплутационными качествами.
Дисциплина материаловедение опирается на знание таких предметов, как химия, физика, биология и математика, а также результатов различных физико-химических методов исследования их структуры и свойств.При этом понимается, что изучение этой связи в материаловедении направлено, прежде всего, на научное прогнозирование структуры и свойств конкретных материалов с целью рационального определения областей их практического использования, а также методов и технологии их переработки в конкретные изделия.
Читатель вправе использовать любой из вышеприведенных вариантов определения термина «материал» «и материаловедение» и зависимости от области его использования и (или) возможного уровня допущении или ограничений, предъявляемых в каждом конкретном случае.
Конечные свойствалюбого металлического и неметаллического материала, а также технологические приемы его переработки в изделия и режимы эксплуатации, определяются его строением. Поэтому одной из основных задач современного материаловедения является раскрытие взаимосвязи основных его понятий и исследование структуры материала на различных уровнях организации (макро-, мезо-, микро-, нано- и электронно-ядерном). Решение этих проблем и ответ на вопрос о единстве природы и различий структуры и свойств металлических и неметаллических материалов заключается в использовании четырех базисных инноваций. К ним относятся: система базовых (основных и производных) понятий (рис. 1.1.), где Э - элемент; унифицированная классификация основных уровней структурной организации металлических и полимерных материалов (табл. 1.1.); единая универсальная модель тонкой химической структуры металлов и неметаллов, как совокупности ковалентной - К (точка К), металлической - М (вдоль оси Х) и ионной - И (вдоль оси Y) составляющих (компонент) химических связей реального взаимодействия атомных остовов (ядер) в гомо- (Э’-Э’) и гетероядерных (Э’-Э’’) соединениях в микроуровне их структурной организации (рис. 1.2) и Система химических связей и соединений (СХСС), объединяющая «чистые» металлы и неметаллы, а также соединения на их основе (рис. 1.3) и раскрывающая общий характер влияния исходной тонкой химической микроструктуры на последующие уровни структурной организации и специфику свойств, включая оценку индивидуального вклада различных ступеней в характеристику конкретного свойства.
При этом тонкий электронно-ядерный (химический) уровень организации материала это та реальная практическая основа, на которой строится вся остальная структурная иерархия в соответствующем материале. В результате именно тип химической связи элементов (ядер или атомных остовов) тонкой структуры материала и определяет возможность их разделения на металлы и неметаллы с соответствующим комплексом индивидуальных физических, механических и других свойств отличающих эти материалы друг от друга (плотность, теплопроводность, электропроводность и т. д.).
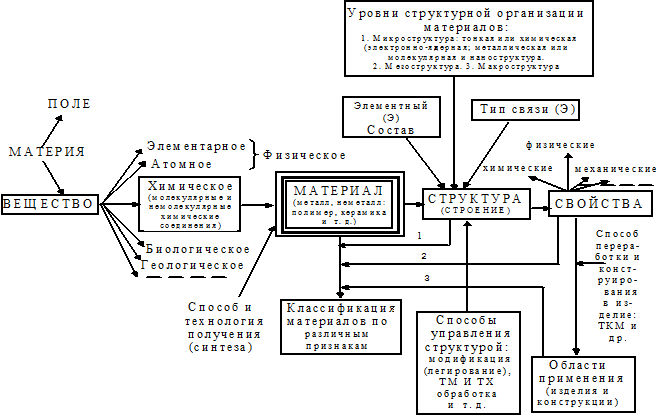
Рис.1.1 - Система и иерархия основных понятий материаловедения и уровней структурной организации материала
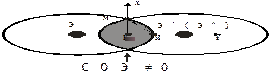
Рис. 1.2 - Плоскостное изображение единой модели химической связи элементов тонкой структуры

Рис. 1.3 - «Химический треугольник» единства и различия химических связей и соединений и основа систематизации природы металлических и неметаллических материалов
Таблица 1.1 - Классификация основных уровней структурной организации металлических и полимерных материалов (О. С. Сироткин)
| Уровни структуры и их размерный интервал | Структурные элементы в металлах | Структурные элементы в полимерах |
| 1. Микроструктура: | Атомные остовы и обобществленные электроны, которые осуществляют химическую связь (преимущественно металлическую в металлах и преимущественно ковалентную в полимерах); точечные дефекты: вакансии и т. д. (0,0001 - 0,0005 мкм) | |
| тонкая | 1а) электронно-ядерная; ~1 – 5 Å (1 - 5·10 -10 м) | |
| 1б) молекулярная; ~5 – 10 Å (0,5 - 1,0·10-9 м) | Молекулы в металлах отсутствуют, поэтому структурными элементами данного уровня в них могут быть дефекты соответствующих размеров (0,0005 - 0,001 мкм) | Фрагменты макромолекул (атомные группировки) и единичные межзвенные (ван-дер-ваальсовые (ВДВ) и водородные) связи и низкомолекулярные вещества |
| 1в) наноструктура; ~10 – 10 000 Å (10-9 - 10-6 м) | Наночастицы (0,001 - 0,1 мкм) и поверхности раздела; Фрагменты, блоки, полигоны (0,1 - 1 мкм) и область когерентного рассеивания (0,001 - 0,01мкм); Линейные дефекты: дислокации и дисклинации (0,1 - 1 мкм) | Макро(олиго-)молекулы, внутри- и межмолекулярное ВДВ и водородное взаимодействие; Надмолекулярные соединения: наночастицы и поверхности раздела; кристаллиты, ламели и границыраздела; линейные дефекты |
| 2. Мезоструктура ~104 - 107 Å (10-6 - 10-3 м) | Субзерна (1 - 100 мкм) и субграницы; Зерна (100 - 1000 мкм) и границы между ними; Поверхностные дефекты (дислокационные ансамбли) | НМС: небольшие аксиалиты, эдриты и сферолиты диаметром до нескольких десятков мкм; Поверхностные и небольшие объемные дефекты (поры и т. д.) |
| 3. Макроструктура ~107 - 109 Å (10-3 - 10-1 м) | Структуры, образованные зернами (волокна, дендриты и т. д.) и поверхность раздела; Крупные объемные дефекты (усадочные раковины, поры, трещины и т. д.) | НМС: крупные надмолекулярные образования в виде крупных аксиалитов, эдритов и сферолитов (от нескольких десятков мкм и выше); Объемные дефекты (трещины и т. д.) |
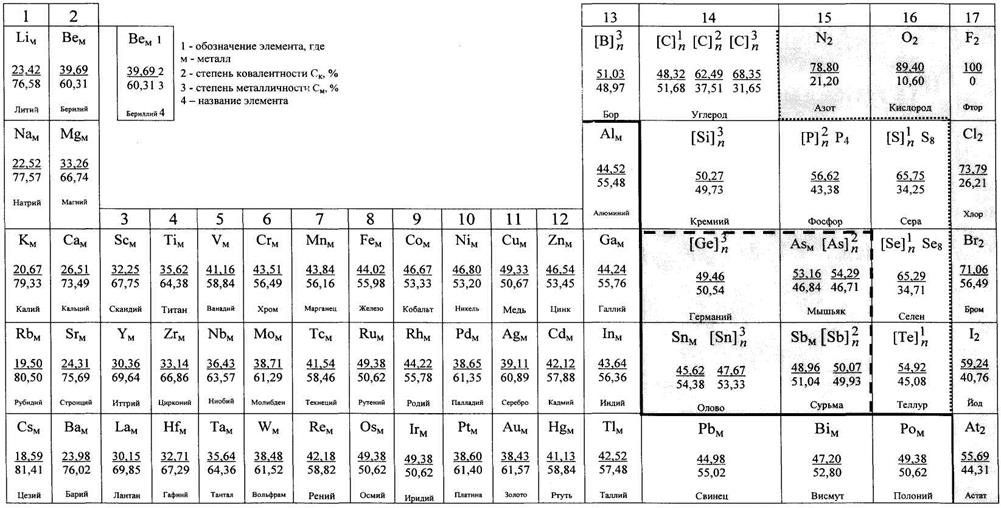
В качестве демонстрации влияния элементного состава и типа химической связи(электронно-ядерная структура материала) на строение идалее насвойстваметаллов и неметаллов оценим воздействие на эти характеристики соотношения степеней ковалентности (Ск) и металличности (См) химических связей на примере гомоядерных соединений элементов Периодической системы (ПС) (табл. 1.2). Представленные данные свидетельствуют, что специфика строения гомоядерных химических соединений и их свойств, включая агрегатное состояние, определяется в первую очередь особенностями их химической связи (ХСв). Это позволило определить возможность конкретизации первого фундаментального уровня классификации (разделения) гомоядерных химических соединений ПС по преобладанию одной из двух компонент связи и провести ее на количественной основе. Характеристика различных металлических и неметаллических структур гомоядерных соединений (табл. 1.2) подразумевает их разделение на ряд следующих видов:
| O2 89,40 10,60 Кислород | - ковалентные низкомолекулярные соединения дискретного типа со строго определенным минимальным числом ядер или ядерных остовов в их структуре. (2, 3, 4, 6, 8…), например два и три ядра для О2 и О3. |
| [C]n 68,35 31,65 Углерод | - ковалентные многоядерные средне- (олиго-, где n ≤ 100), высокомолекулярные соединения (макро-, где обычно n > 100) (дискретного типа) с линейной (к. ч. = 2) или одномерной разветвленной или плоско-сетчатой (к. ч. = 3) или двухмерной организацией, где n- степень полимеризации, а также объемно-сетчатой (к. ч. = 4) или трехмерной структурой (полимерные тела) |
| Alм 44,52 55,48 Алюминий | - металлические многоядерные соединения (непрерывного или бесконечноядерного типа) с числом катионов (типа Al3+) в кристаллической решетке стремящихся к бесконечности (∞) |
По признаку дискретности или непрерывности структурной организации гомосоединений ПС они разделяются на две основные группы: ковалентные (I) или молекулярные (дискретные - конечноядерные) и металлические (II) или немолекулярные (непрерывные – «бесконечноядерные»). Первая группа преимущественно ковалентных связей, характеризуемых соотношением Ск/См (в %) в интервале от 100/0,00 (у F2) до 50,07/49,93 (у [Sb]n), охватывает (табл. 1.2) неметаллические гомосоединения 16-ти р-элементов 13 - 17 групп ПС от F до Sb в ряду:F, О, N, Cl, Br, С, S, Se, I, P, At, Te, As, B, Si, Sb. Причем данные по соотношению Ск/См (табл. 1.2) для связи At-At, равные 55,69/44,31 свидетельствуют о преимущественной ее ковалентности, подтверждая предположение о молекулярной биядерной структуре этого соединения, построенного подобно другим галогенам, но характеризующегося сочетанием свойств неметаллов (галогенов) и металлов (типа Po, Pb и др.). В итоге I группа гомоядерных связей и соединений элементов расположена в правой верхней части ПС, начиная с F2. Вторая группа преимущественно металлических связей, характеризуемых соотношением Ск/См в интервале от 49,38/50,62 (у Poм) до 18,59/81,41 (у Csм), охватывает металлические гомосоединения р-, d- и s-элементов 1 - 16 групп ПС, являясь значительно более многочисленной чем первая, занимая прежде всего левую и среднюю часть длиннопериодного варианта ПС. Гомоядерные связи этих 47 элементов ПС (не считая дополнительно франция, радия, лантанидов и актинидов) и их лабильность обеспечивает образование соответствующего количества различных металлов и их полиморфных модификаций. На основе рассмотренных выше данных, можно уточнить положение «диагональной линии», традиционно проводимой для разделения металлов и неметаллов и которая проходит между парами элементов гомосоединений: B-Al, Al-Si, Ga-Ge, In-Sn, Pb-Sn, Bi-Sb, Po-Te, Po-At (в виде жирной сплошной линии) (табл. 1.2). Переход от одной к другой из двух вышеперечисленных основных групп является постепенным. Следует отметить существование на границе этих двух основных групп (металлов и неметаллов) многоядерных переходных гомосоединений четырех элементов наиболее ярко проявляющих свою двойственность. Три из них (As, Sb и Sn) существуют в виде двух полиморфных форм (металлической и полимерной), а один - Ge (при практическом равенстве Ск и См связи Ge-Ge) обладает алмазоподобной полимерной структурой (полимерное тело) и одновременно обладает целым комплексом признаков и свойств, присущих металлическим или интерметаллическим соединениям. Специфику структуры гомоядерных соединений существующих в виде двух полиморфных форм (Эм и Эн) и причины этого явления можно связать с приблизительным равенством Ск ≈ См и соответствующей электронной конфигурацией элементов их образующих (s2p2 и s2p3). Переход полимерной формы в металлическую должен быть следствием соответствующего изменения типа связи гомоядерного соединения. Например, белое металлическое олово (β-форма) получается при повышении температуры выше 286 К (до 298 К) из серого полимерного олова (α-форма). Это сопровождается изменением алмазоподобной структуры и свойств последнего, когда имеет место рост к. ч. с 4 до 6 и плотности с 5,75 до 7,31 г/см3. Естественно, что См связи должна в этом случае возрастать.
Таблица 1.2 - Периодическая система гомоядерных химических связей элементов и основных типов исходных металлических и неметаллических соединений и материалов их основе (Сироткин О. С. и др.)
В результате в точке пересечения граничных линий четырех гомосоединений Al, Ga, Si и Ge происходит раздвоение жирной линии (с охватом жирным пунктиром гомосоединений элементов Ge, As, Sn, Sb), которая затем вновь объединяется в точке пересечения границы гомосоединений других четырех элементов (Sb, Te, Bi и Po).
Причем, именно вдоль этой «диагональной линии» располагается большее число материалов, обладающих полупроводниковыми свойствами (р-элементы ПС - Si, Р, S, Ge, As, Sе, Sb, Sn, Bi, Te, J), а левее ее - металлические проводники.
Далее внутри первой группы(ковалентных соединений)по признаку конечно- или «бесконечноядерные» вещества следует выделить три подгруппыгомосоединений: Iа, Iб и Iв. подгруппа Iа, отделенная тонкой пунктирной линией,включает в себя семь биядерных молекулярных соединений элементов 15 - 17 групп ПС: F, O, N, Cl, Br, J, At,которые характеризуются изменением соотношения Ск/См (в %) в интервале от 100,00/0,00 до 55,69/44,31. В результате, подтверждается фундаментальное химическое положение, утверждающее, что ковалентносвязаность (или преобладание ковалентной компоненты связи над любой другой) элемента в ХС является основным условием образования молекулярного вещества и материала на его основе.Подгруппа Iб состоит из одно- и двухмерных олиго- и макромолекул на основе шести элементов: P, As, Sb, S, Se, Te. ПодгруппаIв- промежуточных (или переходных) многоядерных гомосоединений, между типично ковалентными (молекулярными) и металлическими. К ним следует отнести преимущественно ковалентные соединения р-элементов 13 и 14 групп ПС (характеризуемые приблизительно равными или близкими по величине Ск и См гомоядерными связями и соответствующей электронной конфигурацией s2p1 и s2p2) в виде алмазоподобных полимерных кристаллов гомосоединений [B]  , [C]
, [C] 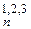 , [Si]
, [Si] 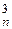 , [Ge]
, [Ge] 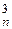 , [Sn]
, [Sn] 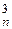 . В этих соединениях степень полимеризации - n (или число ядер в их структуре) реально определить невозможно. Это связано с тем, что они построены не из индивидуальных макромолекул (или высокомолекулярных соединений) с определенной n, (связанных относительно слабым межмолекулярным ван-дер-ваальсовым взаимодействием), а являются трехмерными ковалентными структурами (монокристаллами), называемыми часто полимерными телами. Поэтому применение к ним понятия молекулы или макромолекулы (то есть индивидуальной «частички» дискретного соединения с определенным числом ядер) уже не имеет смысла, и по признаку «бесконечноядерности» эти соединения являются уже более родственными металлическим структурам, а по признаку «ковалентносвязанности» ядер к ковалентным. Причем в следующем ряду этих гомосоединений ([C]
. В этих соединениях степень полимеризации - n (или число ядер в их структуре) реально определить невозможно. Это связано с тем, что они построены не из индивидуальных макромолекул (или высокомолекулярных соединений) с определенной n, (связанных относительно слабым межмолекулярным ван-дер-ваальсовым взаимодействием), а являются трехмерными ковалентными структурами (монокристаллами), называемыми часто полимерными телами. Поэтому применение к ним понятия молекулы или макромолекулы (то есть индивидуальной «частички» дискретного соединения с определенным числом ядер) уже не имеет смысла, и по признаку «бесконечноядерности» эти соединения являются уже более родственными металлическим структурам, а по признаку «ковалентносвязанности» ядер к ковалентным. Причем в следующем ряду этих гомосоединений ([C] 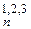 , [Si]
, [Si] 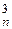 , [Ge]
, [Ge] 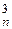 , [Sn]
, [Sn] 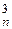 ) вместе с ростом См и постепенным преобразованием ковалентной связи в металлическую наступает момент, когда имеет место образование связи Sn-Sn, которая обеспечивает существование двух полиморфных форм: металлической и неметаллической (ковалентной) полимерной. Далее в гомосоединении Pb имеет место качественный скачек превращения гомоядерной связи Pb-Pb в классическую многоцентровую металлическую с образованием типичного металла (Pbм).
) вместе с ростом См и постепенным преобразованием ковалентной связи в металлическую наступает момент, когда имеет место образование связи Sn-Sn, которая обеспечивает существование двух полиморфных форм: металлической и неметаллической (ковалентной) полимерной. Далее в гомосоединении Pb имеет место качественный скачек превращения гомоядерной связи Pb-Pb в классическую многоцентровую металлическую с образованием типичного металла (Pbм).
Анализ влияния изменения соотношения Ск/См гомоядерной связи на структуру соединений в ряду элементов 16 группы ПС от кислорода к теллуру свидетельствует, что с увеличением См (и соответствующим уменьшением Ск) происходит увеличение числа ядер в устойчивых при нормальных условиях типах ХС на их основе: кислород-2, сера-8, селен и теллур-n и полоний - «бесконечноядерная» кристаллическая металлическая решетка. Аналогичное влияние роста См гомоядерной связи на увеличение числа ядер в структуре веществ наблюдается и для гомоядерных соединений элементов 15 группы ПС сверху вниз. При этом при переходе от гомосоединений элементов 17 и 16 групп ПС к 15 и далее к 14 (внутри соответствующих периодов ПС справа налево) имеет место факт дополнительного влияния электронной конфигурации ядер (атомных остовов) на способность к образованию низкомолекулярных (моно-), олиго- (или мезо-) и высокомолекулярных, а далее и металлических соединений, т. е. при переходе от 17 и 16 к 15, 14, 13 группам и далее (внутри соответствующего периода ПС) в целом увеличивается многоядерность соответствующих гомосоединений. По мере роста См гомоядерной связи элемента внутри периодов справа налево и по мере роста его номера (сверху вниз) вероятность образования стабильных низкомолекулярных веществ (типа F2, О2 и т. д.) постепенно уменьшается, т. е. во втором периоде в обычных условиях гомосоединения образуют максимальное число газообразных мономеров 3 (биядерные молекулы F2, О2 и N2), в 3-м - 2 (Cl2, S8, причем число ядер в мономере все равно увеличивается), в 4-м-1 (Br2) и т. д.
В результате, очевидно, что все практически значимые вещества-материалы (особенно конструкционного типа) представляют собой многоядерные химические системы, появление которых определяется обусловленным граничным значением степени металличности, после достижения которой низкомолекулярные вещества преобразуются в высокомолекулярные (образуя полимеры) и далее в металлические, которые находятся преимущественно в твердом агрегатном состоянии.
Все материалы, окружающие нас и используемые в промышленности, можно объединить в большое количество групп и классов по разным признакам и критериям. Среди существующего разнообразия наиболее востребованными являются металлические и неметаллические материалы. Последние представляют более обширную группу. Она объединяет в себя полимерные, резиновые, керамические, стеклянные и др. материалы. Из них наиболее используемыми являются полимеры и керамика. Особый класс составляют композиционные материалы – композиты. Этосложные материалы, состоящие из двух или более разнородных компонентов (например: стекла и пластмассы - стеклопластики). Их принято классифицировать по типу структуры, материалу матрицы, назначению и способу производства.
Таким образом, основными материалами промышленности и бытового назначения являются металлические, полимерные, керамические и композиционные. Три первых располагаются в вершинах треугольника, а на его площади – композиционные на их основе (рис. 1.4).

Рис. 1.4 - Схема расположения материалов по значимости их применения
Существующие виды классификаций материалов основываются на всевозможных признаках их отнесения к разным группам. Показатели систематизации следующие: происхождение, агрегатное состояние, химический состав и природа, тип связи компонентов, способ получения, структура, свойства, качество и области назначения и применения.
По происхождению материалы разделяются на природные (кварцевый песок, глина, вода, кислород, древесина, углеводороды в виде природного газа, нефти, угля и т. п.), синтетические и искусственные (металлы, керамика, полимеры и т. д.).
Природный материал - это тот вид вещества, который существует в природе независимо от человека, используется им на практике в первозданном виде и (или) обеспечивает возможность получения новых (синтетических или искусственных) материалов (металлов, керамики, полимеров и т. д.), не существующих в природе определяет их структуру, свойства и области применения.
Искусственные и синтетические материалы - это продукты превращения природных веществ в новый их вид, иногда не существующий в земной коре.
Искусственный материал – это не природный, а сделанный наподобие подлинного. То есть такого же состава, строения и свойств.
Синтетический материал – это вещество или соединение, синтезированное химическим путем из простых и сложных веществ с новыми составом, строением и свойствами, и не существующее в природе.
По агрегатному состоянию материалы классифицируют на газообразные, жидкие и твердые, по химическому составу - гомо- и гетероядерные; далее - металлы и неметаллы, по структуре – макро-, микро- и так далее; по свойствам выделяют обычно две основные группы: конструкционные и функциональные, а далее более частные классификации по: проводимости - сверхпроводники, проводники, полупроводники, изоляторы и диэлектрики; твердости; теплостойкости; жаропрочности и теплопроводности; пластичности; фрикционным свойствам - антифрикционные и абразивные и т. д. и т. п.); по способам получения, например,термо- и реактопласты, воздушного и гидравлического отверждения и т. д.; по областям, отраслям применения и назначения на строительные материалы, медицинского, бытового и других назначений, электротехнические, горючесмазочные и другие.
В свою очередь, каждая из вышеперечисленных классификаций имеет свои более детальные подразделы.
Согласно классификации материалов по химической природе, представленной на рис. 1.4, дисциплина «Материаловедение» складывается из четырех больших разделов. Каждый из них называется по наименованию рассматриваемых материалов, а именно металловедение, полимероведение и т. д.
Раздел «Металловедение» представляет собой одну из важнейших составных частей науки о металлах, имеющих весьма широкое практическое применение. Он также является самой обширной областью науки и дисциплины материаловедения.
Цель данного раздела заключается в исследовании зависимости между составом, типом химической связи, строением и свойствами металлов и сплавов, закономерностей их изменения под воздействием внешних факторов: химических, тепловых, механических и электромагнитных.
Металловедение также включает в себя научные основы изыскания технологий производства и обработки металлических материалов с разнообразными механическими, физическими и химическими свойствами; установление закономерностей формирования структуры и свойств изделий при их отливке, обработке давлением, термообработке и др. способах; определение закономерностей изменений структуры и свойств металлических материалов при эксплуатации изделий.
Своей задачей одноименная часть дисциплины ставит ознакомление студентов с металлами и сплавами, методами их исследования и перспективами развития, чтобы в дальнейшем они могли применять свои знания при решении проблем в областях промышленности, в которых используются металлические материалы.
Как самостоятельная наука «металловедение» возникло и оформилось в 19 в., первоначально под названием металлографии. Термин «металловедение» был введен в 20-х годах 20 века в Германии, причем было предложено сохранить название «металлография» только для учения о макро- и микроструктуре металлов и сплавов. Во многих странах «металловедение» по-прежнему именуется «металлографией», а также его называют «физической металлургией». Возникновение «металловедения» как науки было обусловлено потребностями техники.
1831 г. - П. П. Аносов, работавший начальником Златоустовских оружейных заводов и стремившийся раскрыть тайну получения древнего булата, впервые применил микроскоп для исследования строения отполированной поверхности стали, предварительно протравленной кислотой.
1864 г. - английский естествоиспытатель К. Сорби провел подобные исследования макроструктуры железных метеоритов и образцов стали, применив при этом микрофотографию.
1868 г. - Д. К. Чернов указал на существование температур, при которых сталь претерпевает превращения при нагревании и охлаждении (критические точки).
1888 г. - французский инженер Ф. Осмонд измерил эти температуры при помощи термоэлектрического термометра, изобретенного его соотечественником Ле Шателье.
1895 г. - А. А. Ржешотарский создал металловедческую лабораторию на Обуховском заводе в Петербурге.
1897 г. - Ле Шателье сконструировал металлографический микроскоп и английский ученый У. Робертс-Остен исследовал методами термического анализа микроструктуры нескольких двойных металлических систем, в том числе железоуглеродистых сплавов.
1900 г. - нидерландский физико-химик Г. В. Розебом уточнил и обобщил экспериментальные данные о железоуглеродистых сплавах, создав диаграмму Fe-С.
1902 г. - А. А. Байков исследовал явления закалки сплавов. В последующие годы он основал в Петербургском политехническом институте первую в России учебную лабораторию металловедения и создал крупную научную школу металловедов.
1903 г. - Н. С. Курнаков сконструировал самопишущий пирометр, позволивший значительно усовершенствовать методику термического анализа металлов и сплавов.
1904 г. - Н. И. Беляев организовал металловедческую лабораторию на Путиловском заводе в Петербурге.
1906 - 1913 гг. - Н. С. Курнаков и С. Ф. Жемчужный установили зависимости между составом двойных систем и их свойствами - электропроводностью, твердостью и др.
1908 г. - А. М. Бочвар организовал в Высшем техническом училище первую в Москве металлографическую лабораторию.
1918 г. - французские ученые А. Портевен и М. Гарвен установили зависимость критических точек стали от скорости охлаждения.
20-е – 30-е гг. XX в. - в различных странах начались исследования изотермических превращений в сталях (Э. Давенпорт, Э. Бейн, Р. Мейл в США, С. С. Штейнберг, Н. А. Минкевич в СССР, Ф. Вефер в Германии и др.).
В это же время развивалась теория кристаллизации металлов, экспериментальные основы которой были заложены в начале XX в. немецким физико-химиком Г. Тамманом (Я. И. Френкель, В. И. Данилов в СССР, М. Фольмер в Германии, И. Странский в Болгарии).
Важную роль в развитии металловедения сыграл рентгеноструктурный анализ, позволивший определить кристаллическую структуру различных фаз, описать ее изменения при фазовых переходах, термической обработке и деформации (структуру мартенсита, изменения структуры твердых растворов при их распаде и т. д.). В этой области большое значение имели работы Г. В. Курдюмова, С. Т. Конобеевского, Н. В. Агеева (СССР), А. Вестгрена (Швеция), У. Юм-Розери (Великобритания), У. Делингера, В. Кестера (Германия).
В эти же годы А. Ф. Иоффе и Н. Н. Давиденков положили начало теории прочности кристаллов.
1935 г. - А. А. Бочваром изучен механизм эвтектической кристаллизации сплавов.
40-е гг. - Н. Т. Гудцов основал в Московском институте стали новую научную школу в области металловедения и термической обработки стали.
2-я половина XX в. - разработка и внедрение в практику металловедения электронной микроскопии, методов электронной дифракции, нейтронографии, радиоизотопных индикаторов, внутреннего трения, микрорентгеноспектрального анализа, калориметрии, магнитометрии, физики твердого тела, физические методы исследования и др.
Для современного металловедения характерно широкое использование учения о дефектах кристаллической решетки.
Металловедение условно делится на теоретическое, рассматривающее общие закономерности строения и процессов, происходящих в металлах и сплавах при различных воздействиях, и прикладное (техническое), изучающее основы технологических процессов обработки (термическая, литьё, давлением) и конкретные классы металлических материалов.
Основные разделы теоретического курса: теория металлического состояния и свойств металлов и сплавов, механизм и кинетика кристаллизации, фазовые равновесия, диффузия, фазовые превращения в твёрдом состоянии (диаграммы состояния, структура фаз в металлических сплавах), физическая теория процессов пластической деформации (изменение структуры и свойств), упрочнения, разрушения и рекристаллизации, общие закономерности влияния химического состава и типа связи на механические и др. свойства. Его содержание в значительной мере связано с металлофизикой.
Содержанием прикладного металловедения является исследование состава, структуры, процессов обработки и свойств различных конкретных классов металлических материалов (например, железоуглеродистых сплавов, конструкционной и нержавеющей стали, жаропрочных, алюминиевых и магниевых сплавов, металлокерамики). В связи с развитием новых областей техники возникли задачи изучения поведения металлов и сплавов при радиационных воздействиях, весьма низких температурах, высоких давлениях и т. д.
На металловедение опираются такие следующие научные дисциплины, как металлургия, технология металлов и сплавов, коррозия и защита от нее, теория прочности и т. п.
Дата добавления: 2015-09-21; просмотров: 1464;
