АМИНОКИСЛОТЫ. БЕЛКИ
Общее число встречающихся в природе аминокислот достигает 100. Известны 20 наиболее важных α-аминокислот, входящих в состав белков.
Основным источником α-аминокислот для живого организма служат пищевые белки. Многие α-аминокислоты синтезируются в организме, некоторые поступают только извне (незаменимые). α-аминокслоты занимают ключевое положение в азотистом обмене. Многие из них используются в медицинской практике в качестве лекарственных средств. Так, глицин улучшает метаболические процессы в тканях мозга, оказывает положительное действие при мышечной дистрофии. Глутаминовая кислота применяется для лечения заболеваний ЦНС; в виде натриевой соли в качестве вкусовой добавки к пищевым концентратам, так как имеет вкус мяса. Метионин и гистидин применяются для лечения и предупреждения заболеваний печени, цистеин – глазных болезней. Благодаря способности тиольной группы (-SH) к легкому окислению, цистеин выполняет защитную функцию при воздействии на организм веществ с высокой окислительной способностью. Цистеин был первым лекарственным препаратом, проявляющим противолучевое действие. Он также используется в фармацевтической практике в качестве стабилизатора лекарственных препаратов.
Аминокислоты - это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
Н2N-СН2-СООН + HCl → [Н3N-СН2-СООН]+Сl-
Н2N-СН2-СООН + NaOH → H2N-CH2-COONa + Н2О.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H2N-CH2—СООН  Н3N+-СН2—СОO-.
Н3N+-СН2—СОO-.
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин - щелочной (одна группа -СООН, две -NH2).
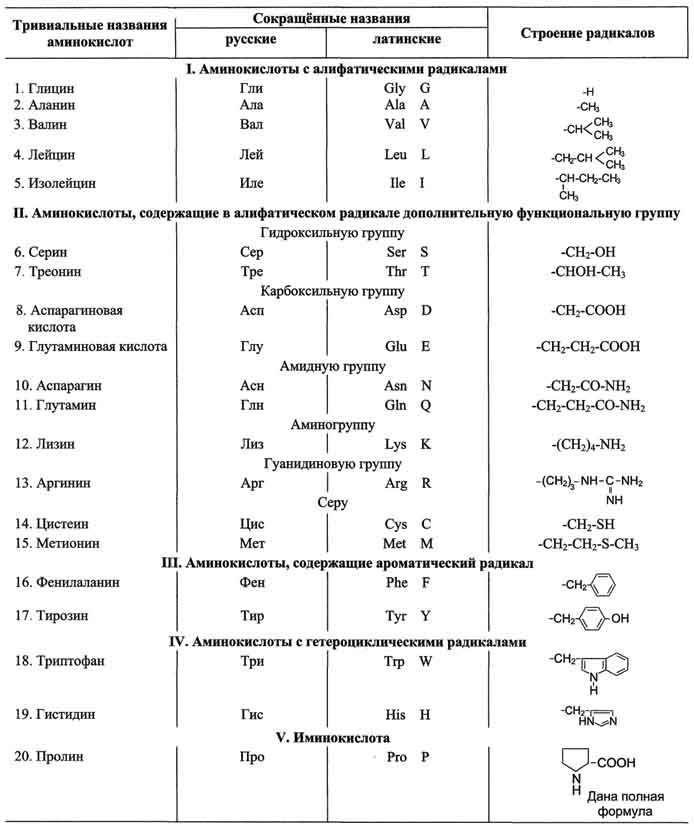
По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические (таблица 1).
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота — в гидроксикислоту:
H2N-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
H2N-CH(R)-COOH + R'OH 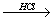 H2N-CH(R)-COOR' + Н2О.
H2N-CH(R)-COOR' + Н2О.
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
Важнейшее свойство аминокислот — их способность к конденсации с образованием пептидов.
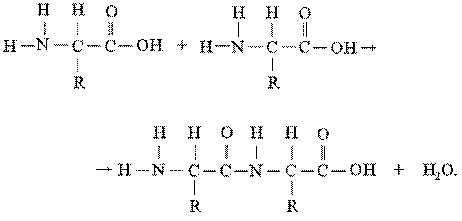
После того как две аминокислоты таким образом соединились, цепь может наращиваться путем добавления ко второй аминокислоте третьей и т.д. Как видно из приведенного выше уравнения, при образовании пептидной связи выделяется молекула воды. В присутствии кислот, щелочей или ферментов реакция идет в обратном направлении: полипептидная цепь расщепляется на аминокислоты с присоединением воды. Такая реакция называется гидролизом. Гидролиз протекает спонтанно, а для соединения аминокислот в полипептидную цепь требуется энергия.
Таблица 1. Классификация основных аминокислот белков по их химическому строению
Денатурация.Синтезированная молекула белка, складываясь, приобретает свойственную ей конфигурацию. Эта конфигурация, однако, может разрушиться при нагревании, при изменении рН, под действием органических растворителей и даже при простом взбалтывании раствора до появления на его поверхности пузырьков. Измененный таким образом белок называют денатурированным; он утрачивает свою биологическую активность и обычно становится нерастворимым. Хорошо знакомые всем примеры денатурированного белка – вареные яйца или взбитые сливки. Небольшие белки, содержащие всего лишь около сотни аминокислот, способны ренатурировать, т.е. вновь приобретать исходную конфигурацию. Но большинство белков превращается при этом просто в массу спутанных полипептидных цепей и прежнюю конфигурацию не восстанавливает.
Качественные реакции на аминокислоты и белок:
1) Все аминокислоты окисляются нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтое окрашивание.
2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой.
3) При добавлении к раствору белка растворов едкого натра и сульфата меди (II) появляется розово-фиолетовое окрашивание за счет образования комплексных соединений меди (II) с пептидными связями. Эта реакция называется биуретовой.
4) При нагревании серусодержащих аминокислот с уксусно-кислым свинцом в щелочной среде образуется осадок черного цвета. Эта реакция называется цистеиновой.
Дата добавления: 2015-09-18; просмотров: 1853;
