ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ БЕЛКОВ В ЖЕЛУДОЧНО-KИШЕЧНОМ ТРАКТЕ
Каждые сутки в организм человека всасывается примерно 100 граммов аминокислот, которые поступают в кровь. Еще 400 граммов аминокислот поступает ежесуточно в кровь в результате распада собственных белков тела. Все эти 500 г аминокислот представляют собой метаболический пул аминокислот.
Припереваривании происходит гидролиз пищевых белков до свободных аминокислот. Процесс переваривания начинаетсяв желудке и продолжается в тонкойкишке под действием протеолитических ферментов, которые называются протеиназами или пептидазами. Существует много разных протеиназ. Они имеются не только в желудочно-кишечном тракте, но и в клетках.
Пути использования аминокислот изображены на рис. 1
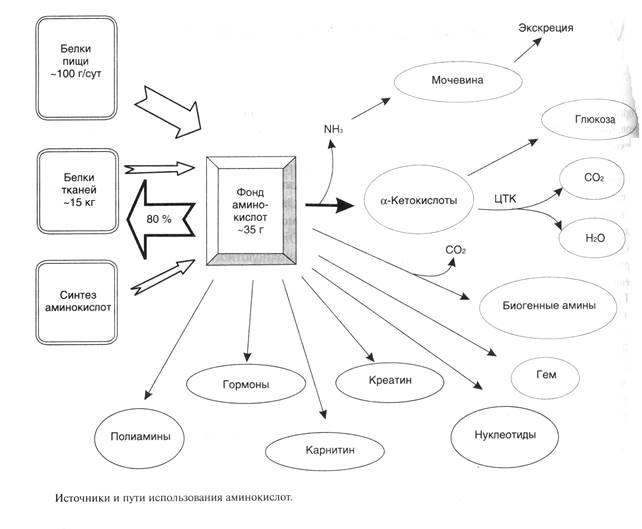
Рисунок 1
Ферменты, участвующие в переваривании белков, обладают относительной субстратной специфичностью, которая обусловлена тем, что пептидазы быстрее гидролизуют пептидные связи между определенными аминокислотами, что позволяет за более короткое время расщепить белковую молекулу.
В зависимости от места расположения в пептиде гидролизуемой связи всепептидазы делятся на:эндопептидазы, которые действуют на пептидные связи, удаленные от концов пептидной цепи (пепсин, трипсин, химотрипсин, эластаза); экзопептидазы, которые действуют на пептидные связи, образованные N- и С-концевыми аминокислотами (аминопептидаза, карбоксипептидазы А и В).
Желудочные и панкреатические пептидазы вырабатываются в неактивной форме (проферменты), секретируются к месту действия, где активируются путем частичного протеолиза (отщепление пептида различной длины с N-конца молекулы профермента).
Место синтеза проферментов (слизистая оболочка желудка, поджелудочная железа) иместо их активации (полость желудка, тонкой кишки)пространственно разделены. Такоймеханизм образования активных ферментов необходим для защиты секреторных клеток желудка и поджелудочной железы от самопереваривания.
Пепсин
Это фермент желудочного сока. Синтезируется в клетках слизистой оболочки желудка в форме неактивного предшественника - пепсиногена. Превращение неактивного пепсиногена в активный пепсин происходит в полости желудка. При активации отщепляется пептид, закрывающий активный центр фермента. Активация пепсина происходит под действием двух факторов: а) соляной кислоты (HCl); б) уже образовавшегося активного пепсина - это называется аутокатализом.
Пепсин является карбоксильной протеиназой и катализирует гидролиз связей, образованных аминокислотами фенилаланином или тирозином, а также связь Лей-Глу. pH-оптимум пепсина равен 1.0-2.0 рН, что соответствует рН желудочного сока.
Реннин
В желудочном соке грудных детей переваривание белков осуществляет фермент РЕННИН, который расщепляет белок молока казеин. Реннин похож по строению на пепсин, но его рН-оптимум соответствует рН среды желудка грудного ребенка (рН=4.5). Реннин отличается от пепсина также механизмом и специфичностью действия.
Химотрипсин.
Синтезируется в поджелудочной железе в форме неактивного предшественника - химотрипсиногена. Активируется химотрипсин активным трипсином и путем аутокатализа. Разрушает связи, образованные карбоксильной группой тирозина, фенилаланина или триптофана, либо крупными гидрофобными радикалами лейцина, изолейцина и валина.
Трипсин
Синтезируется в поджелудочной железе в форме неактивного предшественника - трипсиногена. Активируется в полости кишечника ферментом энтеропептидазой при участии ионов кальция, а также способен к аутокатализу. Гидролизует связи, образованные аргинином и лизином.
Эластаза.
Синтезируется в поджелудочной железе в виде неактивного предшественника - проэластазы. Активируется в полости кишечника трипсином. Гидролизует пептидные связи, образованные глицином, аланином и серином.
Под действием этих протеиназ полипептидная цепь белка расщепляется на крупные фрагменты. Затем на эти крупные фрагменты действуют ЭКЗОПЕПТИДАЗЫ, каждая из которых отщепляет одну аминокислоту от концов полипептидной цепи.
Карбоксипептидазы.
Синтезируются в поджелудочной железе. Активируются трипсином в кишечнике. Являются металлопротеинами. Гидролизуют пептидные связи на С-конце молекулы белка. Бывают 2-х видов: карбоксипептидаза А и карбоксипептидаза В. Карбоксипептидаза А отщепляет аминокислоты с ароматическими (циклическими) радикалами, а карбоксипептидаза В отщепляет лизин и аргинин.
Аминопептидазы.
Синтезируются в слизистой оболочке кишечника. Гидролизуют пептидные связи на N-конце молекулы белка. Существуют 2 таких фермента: аланинаминопептидаза и лейцинаминопептидаза. Аланинаминопептидаза отщепляет только аланин, а лейцинаминопептидаза - любые N-концевые аминокислоты.
Дата добавления: 2015-09-18; просмотров: 1785;
