Группировка по стадиям. Клиническая картина и данные объективного исследования
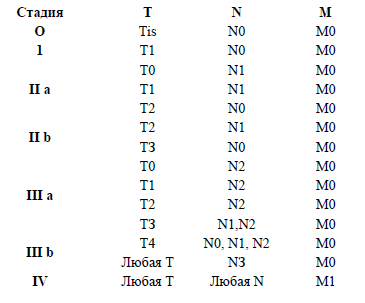
Клиническая картина и данные объективного исследования
Злокачественные опухоли молочной железы развиваются преимущественно у женщин, хотя в небольшом числе случаев (до 1 %) возникают и у мужчин. Правая и левая молочные железы поражаются одинаково часто. Одновременное (двустороннее) поражение обеих молочных желез встречается с частотой от 1,4 % до 13 % в зависимости от формы рака (реже при узловых и чаще при диффузных опухолях).
Ранние фазы развития РМЖ в большинстве случаев протекают бессимптомно. Чаще всего опухоль выявляют случайно сами пациентки или врачи во время профилактического осмотра. К сожалению, обнаружение пальпируемой опухоли нередко свидетельствует
о поздней стадии развития заболевания, когда уже имеются регионарные или отдаленные метастазы рака. В связи с этим для решения проблемы ранней диагностики злокачественных заболеваний молочной железы необходимо выделение групп риска, подлежащих более тщательному и регулярному обследованию.
С этой целью при сборе анамнеза обращают внимание на выявление следующих факторов риска:
I. Экзогенные факторы (ионизирующее излучение, контакт с химическими канцерогенами, прием иммунодепрессантов и некоторых гормональных препаратов, избыточное употребление в пищу животных жиров и высококалорийная диета, курение).
II. Эндогенные факторы:
1. Генетические (РМЖ у кровных родственников, наследуемые синдромы).
2. Нарушения репродуктивной системы (менструальной, половой, детородной, лактационной функций, гиперпластические и воспалительные заболевания яичников и матки):
• нарушения менструальной функции – раннее (до 12 лет) начало менструаций, их нерегулярность, альгополименоррея, позднее (после 55 лет) наступление менопаузы;
• нерегулярность и позднее начало половой жизни;
• кратковременное кормление грудью;
• поздние первые роды (после 30 лет) или отсутствие родов в анамнезе, первичное, вторичное бесплодие;
• заболевания женской половой сферы, протекающие с нарушениями гормонального фона (отсутствие оргазма, фригидность).
3. Эндокринно‑метаболические факторы (гипотиреоз, ожирение, гипертоническая болезнь, сахарный диабет пожилых, атеросклероз, заболевания печени).
4. Предраковые заболевания молочной железы:
• предшествующая или сопутствующая (в течение 5 лет и более) дисгормональная гиперплазия молочных желез (кистозный фиброаденоматоз с протоковой или дольковой пролиферацией эпителия, интрадуктальные папилломы, цистоаденомопапилломы);
• наличие травмы или мастита в анамнезе.
В подавляющем большинстве случаев (около 80 %) РМЖ выявляется в возрасте старше 50 лет, т. е. когда количество известных факторов риска и длительность их воздействия увеличиваются. Однако следует отметить, что почти у половины женщин, заболевших РМЖ, не удается выявить каких‑либо факторов риска этого заболевания.
Так как раннее выявление РМЖ является ведущим прогностическим фактором, способствующим успеху лечения и увеличивающим вероятность полного выздоровления, необходимо рекомендовать пациенткам из групп повышенного риска регулярно самим осматривать молочные железы, ежегодно проходить обследование у маммолога, а женщинам старше 40 лет – раз в год выполнять маммографию.
Помимо факторов риска, при сборе анамнеза у пациентки с уже имеющейся опухолью выясняют данные о сроках появления первых признаков заболевания и динамике его развития (темпы роста опухоли, изменение ее консистенции, признаки поражения кожи над опухолью, изменения характера выделений из соска и т. д.). Также следует отметить, что величина и форма опухоли зависят от ее структуры и типа роста. Медленный рост опухоли не всегда говорит о ее доброкачественности: наиболее часто встречающиеся скиррозные опухоли могут долгое время не увеличиваться или даже иметь тенденцию к уменьшению из‑за параллельно протекающих процессов фиброзирования и сморщивания.
Основными жалобами пациенток, больных РМЖ, являются наличие пальпируемого образования и патологические выделения (серозные, кровянистые, гноевидные) из соска. Боли – это довольно редкий симптом РМЖ. Их причиной могут явиться предсуществующие изменения в молочной железе, сдавление растущей опухолью прилежащих нервных стволов, а также распространение опухоли на кожные покровы или ткани грудной клетки, имеющие хорошую чувствительную иннервацию. Болевой синдром может стать ведущим в картине заболевания при диссеминированном процессе, особенно при метастазировании в кости (при метастазировании во внутренние органы боли выражены меньше). При метастатическом раке молочной железы могут быть жалобы на кашель, одышку, желтуху, рвоту, головную боль, головокружение, диплопию и т. д. (в зависимости от поражения того или иного органа).
Прежде чем приступить к исследованию молочных желез у женщин в детородном возрасте, необходимо уточнить, в какой фазе менструального цикла они находятся. Целесообразно исследовать молочные железы в I фазе цикла – на 2‑3‑й день после окончания менструаций, т. к. во II фазе из‑за нагрубания желез велика вероятность диагностических ошибок.
Для осмотра молочных желез женщине необходимо раздеться до пояса и встать лицом к источнику света, после чего врач оценивает внешний вид желез, обращая внимание на все проявления асимметричности (контуров, окраски кожи, положения сосков и т. д.), наличие патологических выделений из соска. Затем исследуемая должна положить руки за голову, и железы еще раз осматриваются в этом положении. После осмотра производится пальпация молочных желез сначала в положении больной стоя, а затем лежа на спине. Одновременно пальпируются подмышечные, подключичные и надключичные области.
Эти изменения выявляют довольно часто при скиррозной форме рака. При этом железа может уменьшаться в размерах и смещаться кверху и кнаружи (при типичной локализации опухоли в наружноверхнем квадранте). Такая деформация происходит в силу сморщивания в ходе замещения ткани железы фиброзированной опухолевой стромой и хорошо заметна в положении больной стоя с поднятыми вверх руками.
Увеличение молочной железы может возникать либо в результате быстрого развития в ней довольно большой опухоли, выступающей над ее поверхностью, либо в результате выраженного отека (лимфостаза) при блокировании опухолевыми клетками путей лимфо‑оттока. В обоих случаях наблюдается асимметрия молочных желез, являющаяся одним из самых частых признаков заболевания, привлекающим к себе внимание врача и самой больной.
Смещаемость молочной железы на ранних стадиях не ограничена. В последующем, когда опухолевая инфильтрация распространяется на соседнюю клетчатку, кожу или фасцию, на подлежащие мышцы и даже на кости грудной стенки, смещаемость пораженной раком молочной железы относительно прилежащих мягких тканей и грудной стенки ограничивается частично или полностью.
Изменения кожи молочной железы в ряде случаев могут быть связаны с тем, что опухоль распространяется по лимфатическим сосудам, связывающим лимфатическую систему органа с подкожной лимфатической сетью. При этом наступает ограничение смещаемости клетчатки над новообразованием, а затем и кожи над ним и наблюдаются симптомы «площадки» (уплощение и небольшое западение кожи над образованием, возможность взятия кожи в складку резко ограничена или отсутствует), «умбиликации» (полная фиксация, сморщивание и втянутость участка кожи над опухолью), «лимонной корки» (развивается на фоне лимфостаза) (рис. 4, 5).
В ряде случаев вследствие прорастания опухоли в кожу развиваются ее истончение, покраснение и, наконец, изъязвление. При диффузных опухолях может наблюдаться выраженное расширение подкожной венозной сети молочной железы.
Изменения соска не являются ранними симптомами РМЖ. В ряде случаев могут иметь место симптом Форга (сосок пораженной опухолью железы расположен выше горизонтальной линии, проведенной через сосок здоровой железы), симптом Краузе (утолщение соска и складки ареолы). Сморщивание и укорочение млечных протоков в области опухолевого инфильтрата приводят к ограничению смещаемости соска и его втяжению.
Чем ближе к ареолярной области располагается опухоль, тем раньше и рельефнее проявляются эти изменения. Вторым механизмом появления симптома втяжения соска является развитие выраженного отека ареолы, на фоне которого сосок оказывается как бы погруженным в окружающие ткани.
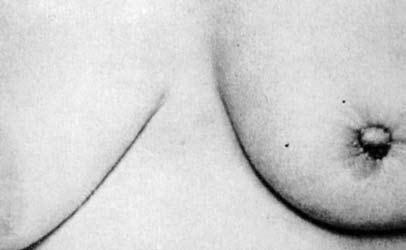
Рис. 4. Скиррозный рак молочной железы: звездчатое втягивание левого соска
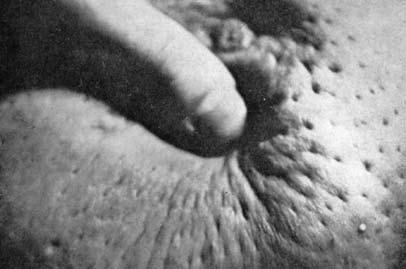
Рис. 5. Симптом «лимонной корки» при неоперабельном раке молочной железы
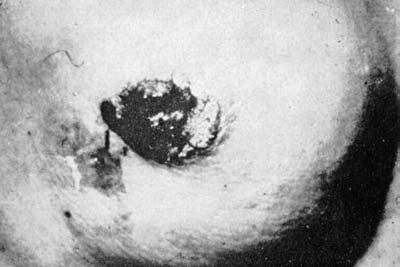
Рис. 6. Карцинома Педжета: полная деструкция соска
Втянутость соска, являясь в типичном случае симптомом рака молочной железы, изредка встречается и при других заболеваниях: хроническом мастите, специфических гранулемах (туберкулез, актиномикоз), кистозной форме мастопатий с вторичной инфекцией. Другие изменения соска наблюдаются при раке Педжета. Это самостоятельная форма плоскоклеточного рака, описанная впервые в 1874 году Педжетом. Отмеченные им изменения соска с самого начала являются следствием развития злокачественной опухоли со своеобразным ростом и течением. Макроскопически наблюдается постепенное покраснение и уплотнение кожи в области соска с образованием мокнущих корок и струпьев, при удалении которых обнажается влажная зернистая поверхность, лишенная эпидермального покрова. Опухоль может захватывать не только сосок, но и ареолу, и даже выходить за ее пределы. Несмотря на значительное распространение, карцинома долгое время развивается поверхностно. Инвазия опухоли вглубь железы происходит преимущественно по выводным млечным протокам (рис. 6).
Выделения из соска встречаются при РМЖ нечасто (5–6% случаев), но иногда они могут быть единственным признаком РМЖ, определяемым при объективном осмотре. Характер выделений чаще всего кровянистый, реже – серозный или гнойный. Хотя выделения из соска не являются патогномоничным симптомом РМЖ, но во всех случаях появления этого симптома необходимо уточнение диагноза путем цитологического исследования выделений и иногда даже гистологического исследования иссеченного подозрительного участка молочной железы (рис. 7, 8, 9).
Пальпация молочных желез должна проводиться в положении больной стоя и лежа на спине. При поверхностной пальпации определяют состояние соска, ареолы, покрывающей железу кожи, симптом «морщинистости» (кожа образует легкую морщинистость при сдавлении ее между двумя пальцами).
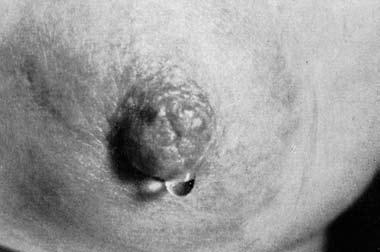
Рис. 7. Серозные выделения из соска при раке молочной железы
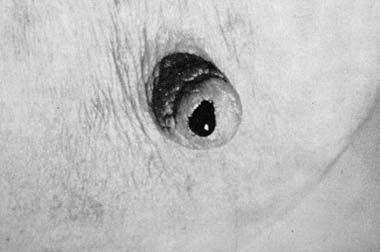
Рис. 8. Выделения из соска в виде капли крови
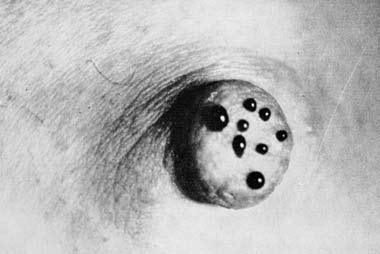
Рис. 9. Кровянистые выделения из многочисленных отверстий при папилломатозе молочных протоков
После поверхностной проводят глубокую пальпацию, при которой оценивают состояние железистых долек, определяют наличие патологических образований в ткани железы. Исследование проводят сначала кончиками пальцев, а затем ткань железы захватывают и исследуют между двумя пальцами или проводят бимануальную пальпацию, при этом последовательно производят пальпаторную оценку всех отделов обеих молочных желез. При выявлении опухоли производят более тщательное исследование соответствующего отдела железы с целью определения размеров, формы, консистенции обнаруженного узла, а также оценку его подвижности и состояния кожи над опухолью.
В ряде случаев, при относительно поверхностном расположении опухоли, можно выявить следующие характерные для рака симптомы: симптом Прибрама (при потягивании за сосок опухоль смещается в том же направлении), симптом Кенига (при пальпации железы всей плоскостью ладони опухолевый узел продолжает определяться отчетливо), симптом Пайра (при захвате кожи над опухолью между двумя пальцами образуются не продольные, а поперечные складки).
Определяемые при пальпации размеры и консистенция опухоли зависят от ее структуры. Как уже указывалось, чаще всего встречается скиррозный рак, при этом опухоль редко достигает больших размеров (обычно 1–3 см). Эта форма карциномы характеризуется инфильтрирующим ростом – узлы не имеют четких границ, обладают хрящевой или каменистой плотностью, имеют бугристую поверхность. Рост таких опухолей нередко сопровождается деформацией, уменьшением и смещением пораженной молочной железы. Быстро растущие солидные, мозговидные и кистозные опухоли при пальпации определяются как относительно мягкие, округлые узлы, иногда с достаточно четкими границами, хорошей смещаемостью и кажущейся «ограниченностью» от окружающих тканей. Они могут достигать большой величины (10 см и более)? сохраняя эти «доброкачественные» признаки.
Пальпаторное исследование подмышечных, подключичных, надключичных и шейных лимфатических узлов является обязательным этапом обследования всех больных с подозрением на заболевание молочных желез. При этом оценивают их количество, размеры и консистенцию узлов, их болезненность, возможную спаянность друг с другом и окружающими их тканями.
Следует иметь в виду, что увеличение регионарных лимфатических узлов при РМЖ не всегда связано с их метастатическим поражением. Иногда гиперплазия лимфоидной ткани связана с банальным воспалительным процессом на верхней конечности. Кроме того, увеличение лимфоузлов может быть следствием перенесенного ранее воспалительного процесса, туберкулезного поражения. Поэтому лишь при морфологическом изучении увеличенных лимфатических узлов можно установить точный диагноз и определить распространенность опухоли. Но иногда, изменения в регионарных лимфатических узлах могут являться единственным клиническим признаком заболевания из‑за малых размеров и глубокого расположения первичного очага.
При размерах опухолевого узла более 1 см при тщательном физикальном исследовании можно выявить РМЖ с высокой степенью вероятности. Однако, для окончательного подтверждения диагноза, а также для раннего выявления опухоли меньших размеров, необходимо использование ряда специальных методов лабораторной и инструментальной диагностики.
Прогноз заболевания и выбор тактики лечения во многом зависят от таких факторов, как форма роста опухоли и его темпы, размер и локализация опухоли, ее морфологические особенности и наличие регионарных и отдаленных метастазов.
По преобладающим клиническим проявлениям макроскопически различают следующие формы РМЖ:
1) диффузный,
2) отечно‑инфильтративный,
3) маститоподобный,
4) рожеподобный,
5) панцирный,
6) локализованный,
7) рак Педжета,
8) узловой.
Диффузные относятся к редким формам РМЖ и характеризуются быстрым развитием опухоли как в самом органе, так и в окружающих тканях, ранним и обширным лимфогенным и гематогенным метастазированием и быстро рецидивируют после, казалось бы, радикального лечения.
Отечно‑инфильтративная форма РМЖ встречается чаще всего у молодых женщин, нередко в период беременности и лактации. Молочная железа при этом увеличена, кожа ее (часто сосок и ареола) пастозна и отечна, может быть легкая гиперемия. Симптом «апельсиновой корки» выявляется над всей железой. Выявить опухолевый узел в ткани молочной железы не удается. При пальпации определяется распространяющееся на значительную часть железы уплотнение по типу инфильтрата без четких границ.
Рожеподобная (эризипелоидная) форма диффузного рака характеризуется не только наличием инфильтрации ткани железы, но и внутрикожным распространением опухолевых клеток по лимфатическим щелям. При этом на коже железы и за ее пределами выявляются участки покраснения, напоминающие рожистое воспаление (раковый лимфангоит).
При маститоподобной форме рака молочная железа увеличена в размерах, кожа гиперемирована, ее температура повышена. При пальпации выявляется значительное уплотнение ткани железы, ограничение ее смещаемости, так как опухоль быстро инфильтрирует все ткани железы, распространяясь на ретромаммарную клетчатку, грудные мышцы, кожу. В толще опухоли формируются очаги распада с присоединением вторичной инфекции.
Панцирный рак характеризуется опухолевой инфильтрацией как самой ткани молочной железы, так и всей толщи покрывающей железу подкожной клетчатки и кожи. При этом железа уменьшается в размерах, фиксируется к грудной стенке. Инфильтрат быстро распространяется на грудную клетку, нередко переходит на вторую железу. На поверхности кожи формируются участки изъязвления. Распространяющаяся опухолевая инфильтрация сдавливает грудную стенку в виде панциря. Из диффузных форм рака панцирная форма протекает наиболее торпидно.
Рак Педжета также относится к редким формам РМЖ. Эта опухоль возникает из стыкового эпителия крупных протоков внутри соска и распространяется как вглубь железы, так и на поверхность соска. Особенности этой формы РМЖ обусловлены тем, что опухоль происходит из клеток области перехода многослойного плоского эпителия ареолы в эпителий выводных млечных протоков. Опухоль обладает смешанными свойствами кожных (медленное течение и плоскостной рост) и протоковых опухолей молочной железы (инфильтративный рост по протокам, возможность регионарного и отдаленного метастазирования). Первыми проявлениями заболевания являются утолщение соска и появление поверхностных экземоподобных изменений соска и ареолы. Заболевание отличается медленным течением. Постепенно развиваются глубокое изъязвление и разрушение соска и ареолы с переходом процесса за пределы последней. Далее формируется плотный опухолевый узел в толще центральной части железы, выявляются регионарные метастазы.
Узловые формы встречаются наиболее часто. Они могут быть представлены инфильтративными и неинфильтративными (отграничено растущими) опухолями. Более чем у 50 % всех больных узловой формой РМЖ опухоль выявляется в верхненаружном квадранте железы, на долю центральной области и верхневнутреннего и нижних квадрантов приходится примерно по 10 % случаев, частота выявления опухолевых узлов в остальных квадрантах составляет примерно 5–7 %. Пальпаторно определяется довольно четко очерченное, округлое, плотное новообразование с мелко– и/или крупнобугристой поверхностью, ограниченно подвижное по отношению к ткани молочной железы в связи с инфильтрацией окружающих структур.
В случае центрального расположения опухоли при малых ее размерах отмечается отклонение соска в сторону или его фиксация. При более распространенном процессе в результате прорастания крупных выводных протоков соска развивается его втяжение.
Соответственно происхождению опухолевых клеток из эпителия млечных протоков или альвеол железы среди узловых форм различают протоковый рак и дольковый рак. Дольковый рак нередко характеризуется мультицентричным ростом. Темпы роста и сроки метастазирования узловых форм рака различаются в зависимости от степени гистологической дифференцировки опухолевых клеток.
Типичными признаками поражения регионарных лимфатических узлов метастазами рака являются увеличение их размеров, плотная консистенция, безболезненность при пальпации. Ограничение подвижности узлов, признаки их фиксации между собой или с окружающими тканями могут свидетельствовать о прорастании опухолевой тканью капсулы лимфатического узла, что является неблагоприятным прогностическим признаком. Выявление метастазов в лимфатических узлах, не являющихся регионарными для пораженной молочной железы, расценивается как наличие отдаленных метастазов и также является крайне плохим прогностическим признаком, так как свидетельствует о генерализации опухоли.
Гематогенные метастазы при РМЖ чаще всего выявляются в легких, плевре, костях, головном мозге, печени, но могут поражать и другие органы, и серозные полости (брюшина, плевра). Частота и сроки возникновения метастазов зависят от длительности существования опухоли, ее размеров, степени злокачественности новообразования, определяемой типом роста и гистологической структурой карциномы.
Лабораторная и инструментальная диагностика
Рентгенологическая диагностика
Маммография – это рентгенологическое исследование молочных желез без применения контрастного вещества. Исследование выполняют на рентгеновском аппарате специальной конструкции, при этом выполняют снимки молочной железы в двух проекциях: краниокаудальной и косой. Дополнительные прицельные снимки с увеличением позволяют повысить точность получаемых данных. Вне зависимости от локализации подозрительного очага выполняют снимки обеих молочных желез, так как приблизительно в 2 % случаев при наличии злокачественной опухоли в одной железе выявляется синхронная непальпируемая опухоль и во второй железе. При маммографии можно выявить до 80 % непальпируемых опухолевых узлов диаметром менее 1 см. При диффузных формах рака диагностическая значимость лучевой диагностики существенно ниже. Характерной рентгенологической картиной злокачественного новообразования на маммограммах является наличие узла высокой плотности (на фоне которого не дифференцируются элементы структуры железы) с неровными контурами и плотными тяжами, расходящимися в окружающие ткани в виде лучей. При высокодифференцированных карциномах опухолевый узел может иметь более правильные округлые формы и четкие границы, что затрудняет дифференциальную диагностику с фиброаденомой или кистой молочной железы. При выраженном фиброаденоматозе дифференцировка опухолевого очага на фоне диффузного уплотнения ткани железы также может быть затруднительна. Дополнительным рентгенологическим признаком, позволяющим выявить опухоль, является наличие микрокальцинатов, которые при карциномах молочной железы выявляются примерно в половине всех случаев. Наиболее характерным для рака является наличие в непосредственной близости от подозрительного уплотнения очаговых скоплений микрокальцинатов различной формы, размеров и плотности. Микрокальцификация чаще наблюдается при внутрипротоковой неинвазивной карциноме, и этот рентгенологический признак нередко является единственным маркером злокачественного роста в молочной железе на ранней стадии заболевания, так как при обычной маммографии эти опухоли невозможно увидеть (рис. 10).
Для диагностики внутрипротоковых новообразований показано выполнение дуктографии молочной железы. Метод заключается во введении через наружное отверстие на соске в млечный проток, из которого имеются патологические выделения, водорастворимого контрастного вещества.
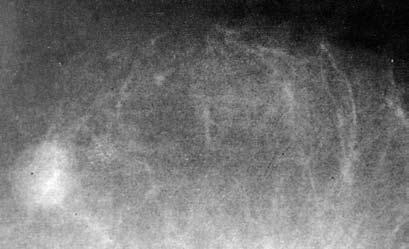
Рис. 10. Оккультный (скрытый) рак, обнаруженный при маммографии
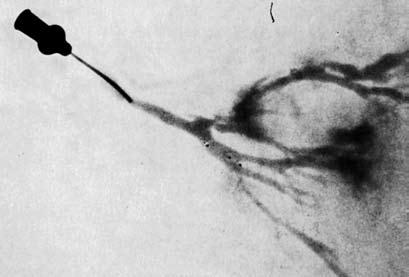
Рис. 11. Дуктограмма: контрастное вещество через выводящий проток попадает в более мелкие протоки молочной железы и окружает там овальное новообразование с неровными контурами
После этого выполняют рентгенографию. Полученные снимки используют для оценки формы и очертаний млечных протоков. Наличие дефектов наполнения просвета протока может свидетельствовать о внутрипротоковом РМЖ (рис. 11). Для ранней диагностики минимальных опухолей, растущих внутри кисты, может быть использован метод пневмоцистографии. Для этого производят пункцию подозрительной кисты, ее содержимое отсасывают, а в полость кисты вводят воздух. Выявление на выполненных после этого снимках дефектов наполнения или деформации кисты может свидетельствовать об опухоли, исходящей из ее стенок.
Следует правильно оценивать диагностическую значимость рентгенологических методов исследования при РМЖ. В случае пальпируемых опухолей частота выявления этих же опухолей при маммографии составляет: для женщин старше 50 лет – 70–80 %, а для женщин моложе 50 лет – 50–70 %. Кроме того, маммография дает в 10–15 % ложноположительный результат, особенно у пациенток в возрасте 40–50 лет, что приводит к выполнению необоснованных дополнительных диагностических процедур и наносит больным психологическую травму. В то же время, по данным маммографических скрининговых исследований, только 60 % опухолей, обнаруженных этим методом, можно было определить пальпаторно, в остальных 40 % опухоль выявлялась только рентгенологически.
Компьютерная томография, магнитно‑резонансная томография более сложные и дорогостоящие, но и в то же время более чувствительные методы исследования, позволяющие врачу отчетливо визуализировать узел в молочной железе, оценить его границы, выявить изменения в прилежащей ткани, уточнить диагноз в спорных случаях, на основании более точного стадирования первичной опухоли выбрать правильную лечебную тактику. Кроме того, томографические методы обладают высокой диагностической ценностью при выявлении метастазов РМЖ.
Ультразвуковое сканирование
Как правило, ультразвуковое исследование применяется для определения характера новообразования, выявляемого в ткани молочной железы при пальпации или другом методе исследования. По сравнению с маммографией в большинстве случаев этот метод является менее надежным в отношении диагностики рака. Однако для выявления минимальных опухолей на фоне фиброаденоматоза, а также при диагностике ранних форм инвазивных дольковых карцином, которые плохо визуализируются при маммографии, ультразвуковое сканирование может оказаться более информативным методом дополнительного исследования. В основном ультразвуковое сканирование молочной железы применяют при проведении дифференциальной диагностики между солидным образованием и кистой, а также при выполнении прицельной пункционной биопсии подозрительных узлов.
Еще одной областью использования ультразвуковых методов диагностики у больных с установленным диагнозом РМЖ является выявление отдаленных метастазов.
Радиоизотопная диагностика
Лимфосцинтиграфия применяется для изучения состояния путей лимфооттока от молочной железы и прогнозирования соответствующих послеоперационных осложнений (например, для выбора операции для предотвращения развития лимфедемы верхней конечности в послеоперационном периоде). Кроме того, радиоизотопное сканирование может быть применено для выявления отдаленных метастазов и уточнения стадии заболевания (сканирование костей, печени).
Термография
При выполнении этого исследования регистрируют данные о температуре поверхности кожи разных отделов молочной железы. Ее повышение свидетельствует об усиленном кровенаполнении, наличии воспаления в отдельных участках органа. Этот метод, к сожалению, не дает точной информации об опухоли и не позволяет получить дополнительных данных, важных для определения прогноза и выбора лечебной тактики. В настоящее время для диагностики РМЖ термография не имеет серьезного клинического значения.
Морфологические исследования
Все подозрительные новообразования, выявленные в молочной железе при клиническом или рентгенологическом исследованиях, должны быть подвергнуты цитологическому или гистологическому авнализу для морфологической верификации диагноза. При обследовании пациентов с подозрением на РМЖ применяют следующие методы:
• цитологическое исследование выделений из соска;
• тонкоигольную аспирационную биопсию;
• трепан‑биопсию;
• инцизионную биопсию;
• эксцизионную биопсию.
Тонкоигольная аспирационная (или пункционная) биопсия является наименее травматичной для пациентки процедурой. Технически эта манипуляция достаточно проста: через кожу над опухолью в толщу ее ткани вводят иглу, закрепленную в шприце, после этого в шприце создают интенсивное разрежение. При этом в иглу аспирируются комплексы клеток и отдельные клеточные элементы опухоли. После этого шприц отсоединяют от иглы, последнюю извлекают и готовят препарат для цитологического исследования. При получении положительного ответа этот метод позволяет не только установить диагноз РМЖ до операции, но и выбрать лечебную тактику (дооперационная химио– или лучевая терапия), планировать объем вмешательства. Тонкоигольная аспирационная биопсия показана всем больным с узловыми образованиями молочной железы.
Выполнение пункционной биопсии целесообразно и при выявлении в молочной железе кистозного образования. Подозрение на злокачественный рост должны вызывать кисты, содержащие кровянистую жидкость, не исчезающие полностью после пункции или быстро наполняющиеся вновь после эвакуации их содержимого. В этих случаях полученное при пункции кисты содержимое должно подвергаться тщательному цитологическому исследованию.
Трепан‑биопсия опухоли с использованием комплекта специальных трепан‑игл позволяет получить столбик ткани опухоли, достаточный для проведения не только гистологического исследования, но и для исследования биологических маркеров опухоли. Кроме того, в отличие от аспирационной биопсии, этот метод позволяет установить является ли рак инвазивным или in situ , что помогает правильно определить тактику дальнейшего лечения.
Следует иметь в виду, что отрицательный результат, полученный при использовании пункционных методов биопсии, не исключает диагноз злокачественной опухоли. При малых размерах карциномы и/или глубоком залегании опухолевого узла игла может пройти мимо новообразования и полученный материал не будет достоверен. Кроме того, не следует относиться к пункционной биопсии как к абсолютно безопасной манипуляции: всегда есть опасность повреждения относительно крупных кровеносных сосудов и образования гематом, диссеминации опухолевых элементов по ходу пункционного канала.
Инцизионная биопсия заключается в иссечении части опухоли с последующим гистологическим исследованием полученного препарата. Этот метод не имеет существенных преимуществ по сравнению с трепан‑биопсией, но является более травматичным и сопряжен с большим риском провоцирования диссеминации злокачественных клеток. В связи с этим выполнение инцизионной биопсии допустимо лишь при наличии обширных инфильтратов неясной природы, не удаляемых путем секторальной резекции.
Эксцизионная биопсия является наиболее достоверным методом верификации морфологического диагноза. При опухолях молочной железы эксцизионная биопсия заключается, фактически, в выполнении операции секторальной резекции. Иссеченный участок железы вместе с опухолью направляют на гистологическое исследование, позволяющее получить максимально полное представление обо всех особенностях опухолевого роста.
Для более точной установки стадии заболевания и, соответственно, определения лечебной тактики и прогноза заболевания может быть выполнена эксцизионная биопсия сторожевых подмышечных лимфатических узлов и их морфологическое исследование.
Микроскопия выделений из соска или с поверхности ареолы проводится при наличии патологических выделений из млечных протоков или при наличии эрозивных изменений, мацерации соска. Выделения из соска (спонтанные или полученные путем активной аспирации), кроме цитологического исследования для выявления опухолевых клеток, должны быть проверены на содержание гемоглобина и эритроцитов. Наличие следов крови в отделяемом, поступающем из млечного протока, может свидетельствовать о протоковой папилломе или карциноме, даже если опухолевые клетки не обнаружены при цитологическом исследовании.
Если подозревают болезнь Педжета, производят цитологическое исследование снятых с мацерированной поверхности соска мазков‑отпечатков или выполняют инцизионную биопсию кожи соска. Диагноз рака Педжета подтверждается морфологически при обнаружении крупных клеток со светлой цитоплазмой и большим гиперхромным ядром, так называемых «клеток Педжета».
Лабораторные исследования
Клинические и биохимические анализы крови не выявляют никаких специфических нарушений на ранних стадиях развития РМЖ.
У пациентов с генерализованным опухолевым ростом в анализах крови могут быть выявлены изменения, свидетельствующие о развитии анемии, нарушении белкового баланса, воспалительной реакции. Повышение уровня щелочной фосфатазы нередко связано с наличием в печени метастазов.
Выявление маркеров опухолевого роста в настоящее время все чаще используют для диагностики и определения прогноза у больных со злокачественными новообразованиями молочной железы. К таким маркерам относятся: раковоэмбриональный антиген (РЭА), тканевой пептидный антиген, ферритин сыворотки крови, органоспецифические антигены (gp52), дифференцировочные антигены (DF3), рецепторы факторов роста (включая онкогены, например HER‑2neu), опухолесупрессорные гены (р53) и др. Факт выявления этих маркеров в крови, отделяемом из сосков, биопсийном материале может помочь в диагностике РМЖ и уточнении прогноза заболевания.
Определение рецепторов эстрогенов и прогестерона является основным биологическим тестом, имеющим существенное значение для выбора лечебной тактики при РМЖ.
Лечение рака молочной железы
Выбор оптимальной схемы лечения РМЖ представляет собой трудную задачу. Лечение планируют в зависимости от стадии заболевания, темпов роста опухоли, выраженности инфильтративного компонента, состояния окружающих опухоль тканей, возраста больной, ее гормонального фона, иммунобиологического статуса, сопутствующих заболеваний, общего состояния и т. д.
В настоящее время в соответствии с минимальными клиническими рекомендациями ESMO (Европейского общества медицинской онкологии – 2003 г.) используется мультидисциплинарный подход к лечению больных РМЖ с включением как локальной, так и системной терапии.
Локальная терапия
1. Хирургическое лечение:
а) радикальная мастэктомия по Halsted‑Meyer;
б) расширенная радикальная мастэктомия по Urban‑Холдину;
в) модифицированная радикальная мастэктомия по Patey‑Dyson;
г) модифицированная радикальная мастэктомия по Madden;
д) органосохраняющие операции.
2. Лучевая терапия.
Системная терапия
1. Химиотерапия.
2. Гормонотерапия.
3. Экспериментальные методы лечения.
Сочетание различных вариантов локального воздействия на опухоль обозначается как «комбинированное лечение». Применение способов локального воздействия на опухоль совместно с методами системной терапии называется «комплексным лечением».
Методы локальной терапии
Хирургическое лечение.
Основным методом локальной терапии РМЖ является хирургическое лечение. Как и при других онкологических операциях, при оперативном лечении больных со злокачественными заболеваниями молочной железы основными принципами радикального хирургического вмешательства являются абластика и антибластика. В зависимости от местно‑регионарного распространения при РМЖ могут выполняться различные по объему операции.
Радикальная мастэктомия по Halsted‑Meyer (по Холстеду‑Майеру) (Halsted W., 1889; Meyer W., 1894). Молочную железу с опухолью удаляют единым блоком с большой и малой грудными мышцами, а также с клетчаткой подмышечной, подлопаточной и подключичной областей, содержащей подлопаточные и подмышечные лимфатические узлы трех уровней (рис. 12). Эта операция являлась «золотым стандартом» до 60‑х годов прошлого века и выполнялась в большинстве случаев при I–III стадиях РМЖ.
Расширенная радикальная мастэктомия по Urban‑Холдину (по Урбану‑Холдину) (Urban J., 1951;
Холдин С. А., 1955). Этот вариант радикальной мастэктомии был предложен для хирургического лечения больных с опухолями, локализованными во внутренних квадрантах молочной железы и предусматривал, в дополнение к оперативному вмешательству в объеме мастэктомии по Halsted‑Meyer, выполнение парастернальной лимфаденэктомии, что сопровождалось резекцией хрящевых частей II–IV ребер и продольной резекцией грудины на этом уровне (рис. 13).
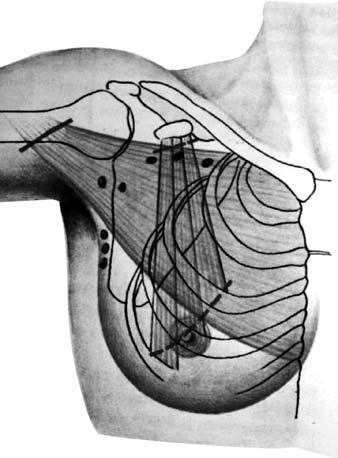
Рис. 12 . Радикальная мастэктомия по Холстеду‑Майеру. Объем иссекаемых тканей (схема).
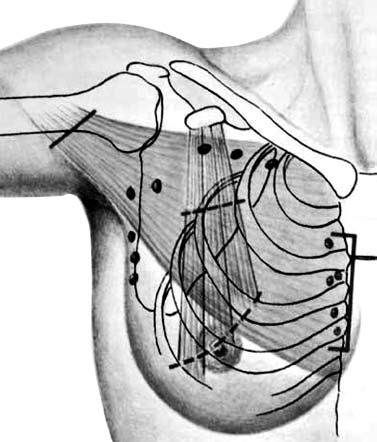
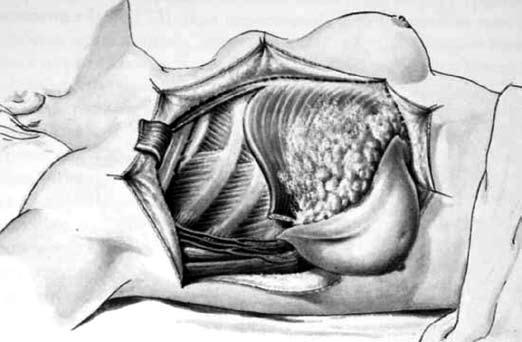
Рис. 13 . Расширенная радикальная (подмышечно‑грудинная) мастэктомия по Урбану‑Холдину. Объем иссекаемых тканей (схема)
В связи с большой травматичностью этой операции ее выполнение было показано лишь в ограниченном числе случаев. В последние годы разработана методика выполнения видеоторакоскопической парастернальной лимфаденэктомии, которая значительно легче переносится больными. На протяжении второй половины XX века в подходах к лечению РМЖ сформировались новые тенденции, заключающиеся в уменьшении объема хирургического вмешательства без ущерба для радикализма лечения. Это стало возможным в связи с совершенствованием методов лекарственной и лучевой терапии, увеличением числа больных, у которых опухоль выявляли на более ранних стадиях развития. Разработка и внедрение в клиническую практику таких операций продиктованы не только стремлением снизить риск хирургического вмешательства, но и возможностью минимизировать отрицательные последствия проводимого лечения. Их применение позволяет добиться лучшей функциональной реабилитации пациентов и создает более благоприятные условия для последующего пластического восстановления удаленной молочной железы.
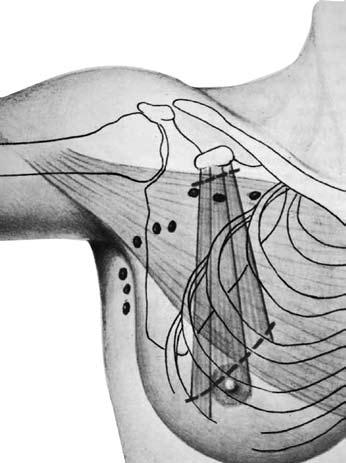
Рис. 14. Модифицированная радикальная мастэктомия по Пейти‑Дайсену. Объем иссекаемых тканей (схема)
К функционально‑щадящим операциям относятся модифицированная радикальная мастэктомия по Patey‑Dyson (по Пейти‑Дайсену) (Patey D., Dyson W., 1948) и модифицированная радикальная мастэктомия по Madden (1973), которые в последние два десятилетия практически вытеснили операцию по Halsted‑Meyer у пациентов с I–II стадиями заболевания. Операция по Patey‑Dyson заключается в удалении молочной железы с опухолью единым блоком с подмышечными лимфатическими узлами двух уровней и малой грудной мышцей (рис. 14). Эта операция является менее травматичной, чем мастэктомия по Halsted‑Meyer, так как сохраняется большая грудная мышца.
Еще менее травматичной является мастэктомия по Madden (по Маддену), так как при ней производится удаление только молочной железы с опухолью единым блоком с подмышечными лимфатическими узлами 1–2 уровней, а большая и малая грудные мышцы сохраняются (рис. 15).
В связи с тем, что при всех представленных выше типах хирургических вмешательств производится удаление молочной железы, эти операции являются не только весьма травматичными, но и сопровождаются тяжелыми психоэмоциональными последствиями для пациенток. Для уменьшения этих последствий в настоящее время в программах лечения и реабилитации больных РМЖ все большее внимание уделяется использованию методов пластической хирургии, так как отмечено, что проведение реконструктивных операций приводит к улучшению качества жизни пациенток. Суть пластических операций заключается в восстановлении размеров и формы молочной железы с достижением хорошего косметического эффекта.
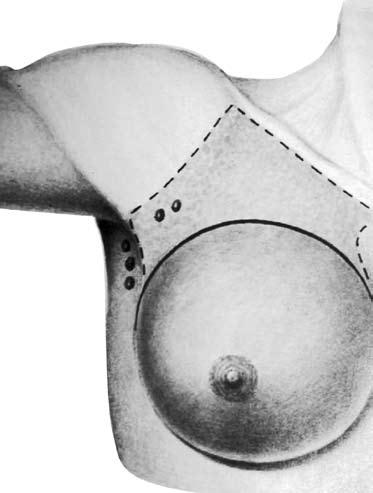
Рис. 15 . Мастэктомия с лимфаденэктомией по Маддену. Объем иссекаемых тканей (схема)
Реконструктивные операции подразделяются на первичные и вторичные. Первичные реконструктивные операции проводятся непосредственно после выполнения мастэктомии, вторичные – спустя 6 и более месяцев после радикального оперативного вмешательства. Для воссоздания контуров удаленной железы предпочтительнее использовать собственные ткани, в основном кожно‑мышечные лоскуты с прямой мышцей живота или широчайшей мышцей спины.
Использование синтетических имплантатов (экспандеры, силиконовые протезы) для пластики молочной железы у онкологических больных менее желательно в связи с повышенной вероятностью развития при этом инфекционных осложнений.
Воссоздание сосковоареолярного комплекса может быть выполнено либо путем пересадки части ареолы противоположной молочной железы, либо с помощью нанесения специальной татуировки на участок кожи в области вновь создаваемой ареолы. Состояние после пластических операций не препятствует проведению лучевой или химиотерапии и не влияет на показатели выживаемости пациентов в отдаленном периоде.
Органосохраняющие операции представляют собой различные варианты расширенной секторальной резекции молочной железы, при которых одновременно выполняют лимфодиссекцию (узлы 1–2 уровней) подмышечного пути лимфооттока (рис. 16). При этом сохраняют нормальный внешний вид молочной железы с целью обеспечения более полноценной психологической и социальной реабилитации больных. К операциям этого типа относятся лампэктомия (опухоль удаляется в пределах здоровых тканей, отступя от ее краев не менее 1 см; оперативное вмешательство не должно приводить к деформации молочной железы) и сегментэктомия (удаление опухоли в пределах здоровых тканей, отступя от ее краев не менее 2 см; в препарат включают проток между опухолью и соском).
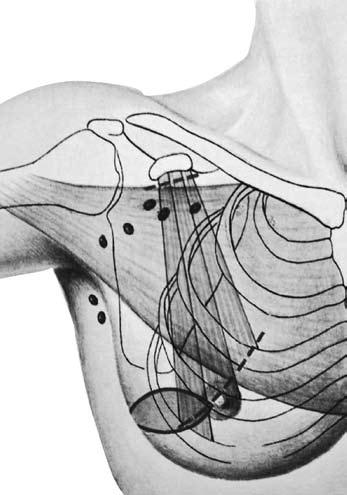
Рис. 16. Радикальная резекция молочной железы. Объем иссекаемых тканей (схема)
Органосохраняющие операции могут применяться только при узловом типе роста опухоли по четко ограниченным показаниям: в I–IIa стадиях заболевания при расположении единичного опухолевого узла в верхненаружном квадранте молочной железы. Во время операции проводится тщательный микроскопический контроль краев раны по линии резекции. В большинстве случаев после операции этим больным требуется проведение соответствующих курсов лучевой терапии. При всех хирургических вмешательствах, включающих выполнение подмышечной лимфодиссекции, неизбежно пересекается большая часть лимфатических коллекторов, обеспечивающих дренаж лимфы от соответствующей верхней конечности. В связи с этим у многих пациенток, перенесших радикальное хирургическое вмешательство по поводу РМЖ, со временем развивается лимфатический отек верхней конечности на стороне операции, что может существенно ухудшать качество их жизни.
Простая мастэктомия (ампутация молочной железы) не является радикальной операцией. Ее применение оправдано у больных с IV стадией рака в качестве циторедуктивной или симптоматической операции при больших распадающихся опухолях, а также во II–III стадиях заболевания при наличии общих противопоказаний к выполнению операций большего объема.
Лучевая терапия Лучевая терапия (предоперационная или послеоперационная) является одним из важнейших компонентов комбинированного и комплексного лечения РМЖ. Целью лучевой терапии является разрушение как первичной опухоли, так и регионарных метастазов и метастазов в отдаленных органах и тканях. Дистанционная лучевая терапия проводится на линейных ускорителях или гамма‑аппаратах.
Проведение курса предоперационной лучевой терапии показано у пациенток с узловыми местно‑распространенными и диффузными формами рака при IIB‑III стадиях заболевания. Такая подготовка позволяет повысить эффективность последующего радикального хирургического вмешательства.
Послеоперационная лучевая терапия назначается в тех случаях, когда признаки значительного распространения злокачественного процесса (прорастание фасции большой грудной мышцы, множественные (не менее четырех) метастазы в регионарных узлах) – были выявлены только во время операции. Кроме того, проведение курса послеоперационной терапии показано пациенткам, перенесшим органосохраняющие операции, а также в случаях локализации опухоли в центральных и внутренних отделах молочных желез (лучевое воздействие на загрудинные лимфатические узлы у этих больных производится в качестве альтернативы выполнению операции по Urban‑Холдину).
Кроме того, для лечения РМЖ с метастазами в кости применяется также и системная радионуклидная терапия (препарат 89Sr‑хлорид).
Методы системной терапии
Проведение только местно‑регионарного лечения (хирургического и лучевого) не позволяет во всех случаях добиться полного излечения, так как при любой стадии РМЖ может иметь место доклиническая диссеминация опухолевых клеток. Основной целью системной противоопухолевой терапии является подавление роста оставшихся в организме злокачественных клеток, в связи с чем чаще это лечение назначается после проведения локального лечения, т. е. в качестве адъювантной (вспомогательной) терапии.
Химиотерапия Адъювантную химиотерапию назначают после устранения первичной опухоли (с помощью операции, лучевой терапии или комбинации этих методов) для ликвидации как выявленных (в том числе и отдаленных), так и возможных, но еще не проявляющихся клинически, метастазов. Цель ее – разрушение отдаленных мелких метастазов и предотвращение рецидива. Неоадьювантная химиотерапия назначается до хирургического лечения или облучения первичного очага при больших местно‑распространенных опухолях. Ее цель – уменьшение размеров опухоли, обеспечение «операбельности» опухоли и повышение эффективности лечения. Чем меньше клонов резистентных клеток, тем больше вероятность «перевести» заболевание в более низкую стадию и тем эффективнее неоадъювантная химиотерапия.
При подборе препаратов для полихимиотерапии применяются следующие принципы: каждый препарат в отдельности должен быть активен в отношении данной опухоли; препараты должны иметь различные механизмы действия и различные профили токсичности; каждый препарат назначают в оптимальной дозе и по оптимальной схеме; интервалы между циклами полихимиотерапии подбирают в зависимости от токсичности препаратов для здоровых тканей. Для обеспечения эффективности проводимого лечения количество курсов химиотерапии должно составлять от 4 до 8, в зависимости от стадии заболевания.
Следует иметь в виду, что все современные противоопухолевые препараты оказывают на организм пациентов побочное токсическое воздействие. Чаще всего при проведении химиотерапии отмечаются симптомы токсического поражения костного мозга (анемия, лейкопения, тромбоцитопения); желудочно‑кишечного тракта (тошнота, рвота), а также кожи и слизистых (стоматит, алопеция, сухость кожи, сыпь, гиперпигментация, изменения ногтей). У большинства пациентов эти осложнения имеют временный и обратимый характер, особенно при проведении соответствующей симптоматической терапии. В связи с токсическим воздействием противоопухолевых препаратов на иммунную систему и на функцию основных жизненно важных органов проведение химиотерапии абсолютно противопоказано у пациентов с острыми инфекционными заболеваниями, при наличии признаков выраженного угнетения миелопоэза, при некомпенсированном сахарном диабете, а также у больных с явлениями печеночно‑почечной или сердечно‑легочной недостаточности.
Гормонотерапия Согласно современным представлениям пролиферативные процессы в нормальной и опухолевой ткани молочной железы зависят от сочетанного влияния эстрогенов и гормонов передней доли гипофиза.
Гормоночувствительность клеток РМЖ в значительной степени определяется наличием на их мембране рецепторов эстрогенов (РЭ) и прогестерона (РП). Частота обнаружения рецепторов эстрогенов и прогестерона в разных возрастных группах (пременопаузальная и постменопаузальная) различна: у 45 % больных в пременопаузе и у 63 % больных в постменопаузе опухолевые клетки содержат оба этих рецептора; эффективность гормонотерапии у этих пациенток достигает 50–70 %. Если присутствуют рецепторы только одного вида (РЭ или РП) эффективность лечения снижается до 33 %. У 28 % больных в пременопаузе и 17 % больных в постменопаузе рецепторы к эстрогенам и прогестерону отсутствуют – у этих групп пациентов гормонотерапия может быть успешной лишь в небольшом проценте случаев (около 11 %).
Таким образом, проведение гормонотерапии показано больным диссеминированным РМЖ при наличии в опухоли одного или двух видов рецепторов. При неизвестном рецепторном статусе с этого вида системной терапии следует начинать, прежде всего, у больных с косвенными признаками гормоночувствительности, к которым относятся пожилой (постменопаузальный) возраст, медленное прогрессирование заболевания, преимущественное метастазирование в мягкие ткани и кости. При проведении гормонотерапии возможно использование одного из двух основных подходов: либо подавление продукции эстрогенов в яичниках и надпочечниках, либо блокирование влияния этих гормонов на метки опухоли.
В связи с тем, что в пременопаузном периоде яичники являются основным источником эстрогенов, подавление синтеза эстрогенов у менструирующих женщин может быть достигнуто путем выполнения овариоэктомии. Впервые данные об успешном лечении трех женщин, больных распространенным РМЖ, которым была произведена двусторонняя овариоэктомия, были опубликованы хирургом из Глазго Jeoral Beatsou в 1896 г. В связи с тем, что надпочечники также являются источником стероидных гормонов, в том числе эстрогенов, продолжая продуцировать их и с наступлением менопаузы, в середине XX века для лечения больных РМЖ было предложено выполнение билатеральной адреналэктомии, а также гипофизэктомии (для подавления выработки рилизинг‑гормонов, стимулирующих выработку лютеинизирующего и фолликулостимулирующего гормонов).
В настоящее время хирургические методы гормонотерапии при РМЖ практически не применяются и представляют только исторический интерес. В качестве альтернативы методам хирургической эндокринологии в последние годы хорошо себя зарекомендовало применение эндокринных лекарственных препаратов системного действия. Пациенткам, находящимся в периоде пременопаузы, с целью медикаментозной кастрации назначают синтетический аналог природного гонадотропин‑рилизинг гормона (гозерелин, золадекс). Применение гозерелина – это новые современные возможности выключения эстрогенной функции яичников у женщин в репродуктивном периоде и в пременопаузе. При постоянном применении гозерелин ингибирует выделение гипофизом лютеинизирующего гормона, что ведет к снижению концентрации эстрадиола в сыворотке крови у женщин. Результаты клинических испытаний показали, что частота объективного эффекта при лечении этим препаратом сходна с таковой при хирургической овариоэктомии.
У неменструирующих больных с положительными рецепторами эстрогенов наиболее эффективным методом гормонотерапии является назначение антиэстрогенов (тамоксифен, торемифен). Тамоксифен до настоящего времени остается «золотым стандартом» гормонотерапии. Механизм действия его следующий: препарат обладает большим сродством к рецепторам эстрогенов, чем сами эстрогены, поэтому происходит блокада рецепторов и нейтрализация влияния эстрогенов как на нормальные, так и на опухолевые клетки молочной железы. Тамоксифен эффективен при всех стадиях РМЖ. У больных с устойчивостью к тамоксифену, развившейся после начального положительного ответа, часто наблюдают положительную реакцию и на применение эндокринных препаратов второй линии – ингибиторов ароматазы, которые заменили адреналэктомию. У женщин в постменопаузальном периоде основным механизмом продукции эстрогенов является превращение с помощью фермента ароматазы адренального стероида андростендиона в эстрон, а затем в эстрадиол. Кроме того, имеются данные, что у женщин в глубокой менопаузе андростендион может вырабатываться не только надпочечниками, но и яичниками. При этом также происходит превращение андрогена андростендиона в эстрогены под действием фермента ароматазы. Сейчас появилось новое поколение этих препаратов (форместан, анэстрозол), которые избирательно блокируют реакцию ароматизации, и поэтому их применение не требует параллельного проведения заместительной терапии минералокортикоидами.
Несмотря на различные механизмы действия, роль гормонотерапии сводится, в конечном счете, к уменьшению влияния эстрогенов на раковые клетки, что в случае гормонально‑зависимого рака приводит к замедлению роста опухоли, а у некоторых больных – к уменьшению уже существующих опухолевых масс, вплоть до их полного исчезновения.
Экспериментальные методы лечения Активная или пассивная иммунизация. В отличие от иммунизации при инфекциях, эти методы при онкологических заболеваниях малоэффективны. В ряде случаев при применении пассивной иммунизации может развиваться опухолестимулирующий эффект, природа которого не очень понятна. Несмотря на это, в настоящее время изучаются перспективы использования высокоспецифичных моноклональных антител в качестве «транспорта» для доставки химиопрепаратов, радиоизотопов, противоопухолевых антибиотиков непосредственно в зону роста злокачественных клеток.
Применение цитокинов и иммуномодуляторов. В последние годы ведутся интенсивные клинические испытания иммуномодуляторов – препаратов, изменяющих биологическую реакцию организма на опухоль, оказывающих неспецифическое стимулирующее влияние на различные звенья иммунного ответа. В настоящее время применяют следующие препараты: тималин и тимоген (применяются в сочетании с полихимиотерапией, усиливая дифференцировку лимфоцитов вилочковой железы), левамизол или декарис (увеличивают количество Т‑лимфоцитов), лейкинферон (лейкоцитарный интерферон человека, стимулирующий дифференцировку Т‑лимфоцитов‑киллеров).
Однако в клинической онкологии не найдены методы активной иммунотерапии, вызывающие стойкий и напряженный специфический иммунитет к опухолевым клеткам. Наблюдаемое улучшение состояния пациентов при всех изученных методах, к сожалению, носит временный и непродолжительный характер.
Молекулярно‑генетические методы Ведется поиск генно‑инженерных подходов к лечению злокачественных опухолей. Например, перенос генов, кодирующих цитокины (фактор некроза опухолей, интерлейкин‑2), в опухолевые клетки позволяет повысить противоопухолевый иммунитет. Введение в инфильтрирующие опухоль лимфоциты гена, кодирующего фактор некроза опухоли, приводит к увеличению концентрации этого цитокина в опухоли без системного токсического эффекта. Введение генов химерных противоопухолевых антител в Т‑лимфоциты помогает добиться направленной цитотоксической активности. Возможно, что в перспективе с помощью переноса нормальных генов в опухолевые клетки удастся скорректировать генетические нарушения, ответственные за бесконтрольный рост опухоли.
Эти методы пока находятся в стадии разработки и не имеют существенного практического воплощения.
Дата добавления: 2015-09-18; просмотров: 1087;
