Выполнение работы. В пробирку налить поровну насыщенные растворы нитрита натрия NaNO2 и хлорида аммония NH4Cl (общий объем не более 1/3 пробирки) и слегка подогреть до начала
Опыт 1. Получение азота
В пробирку налить поровну насыщенные растворы нитрита натрия NaNO2 и хлорида аммония NH4Cl (общий объем не более 1/3 пробирки) и слегка подогреть до начала реакции. Ввести в выделившийся газ горящую лучинку. Что наблюдается?
Требование к результатам опыта:
Составить уравнение реакции получения азота.
Опыт 2. Получение аммиака
Поместить в сухую пробирку 2 шпателя смеси, состоящей из равных частей хлорида аммония и оксида кальция CaO. Нагреть. Осторожно понюхать выделяющийся газ. Подержать над отверстием пробирки смоченную водой красную лакмусовую бумажку. Что наблюдается? Смочить стеклянную палочку концентрированной соляной кислотой и поднести к отверстию пробирки. Что происходит?
Требование к результатам опыта:
1. Составить уравнения реакций получения аммиака и взаимодействия его с HCl.
2. Сделать вывод о кислотно-основных свойствах гидроксида аммония.
Опыт 3. Разложение солей аммония
· В небольшую фарфоровую чашку положить 2-3 шпателя дихромата аммония (NH4)2Cr2O7 в виде горки и горящей спичкой нагреть ее сверху. Что наблюдается?
· Поместить в сухую пробирку несколько кристаллов NH4Сl. Нагреть. Через некоторое время на холодных частях пробирки образуется белый налет, на дне ничего не остается.
Требование к результатам опыта:
Составить уравнения реакций разложения дихромата аммония и хлорида аммония.
Опыт 4. Восстановительные свойства аммиака
Налить в пробирку 0,5-1 мл раствора перманганата калия KMnO4 и добавить столько же концентрированного раствора аммиака NH4OH. Смесь слегка подогреть. Что происходит с окраской раствора?
Требования к результатам опыта:
1. Написать уравнение реакции, учитывая, что аммиак окисляется до свободного азота, а перманганат восстанавливается до MnO2.
2. Сделать вывод, какие свойства, окислительные или восстановительные, проявляет аммиак.
Опыт 5. Получение оксида азота (П)
(Проводить под тягой!). В пробирку внести шпатель медных стружек, прилить 2-3 мл разбавленной азотной кислоты. Выделяется бесцветный газ NO, буреющий на воздухе.
Требование к результатам опыта:
Составить уравнение реакции получения оксида азота (П).
Опыт 6. Получение и свойства оксида азота (IV)
(Проводить под тягой!). В пробирку внести шпатель медных стружек, налить 2-3 мл концентрированной азотной кислоты. Образующийся в этой реакции NO2 через газоотводную трубку пропускать в пробирку с водой, в которую добавить 2-3 капли метилоранжа. Что наблюдается? Почему? Затем образующийся NO2 пропускать в пробирку с раствором NаОН. К полученному раствору добавить по каплям подкисленный раствор перманганата калия. Что наблюдается?
Требование к результатам опыта:
Закончить уравнения реакций: Cu + HNO3 (конц.) =;
NO2 + H2O =;
NO2 + NaOH =;
KMnO4 + NaNO2 + H2SO4 =
В каждой реакции указать окислитель и восстановитель.
Опыт 7. Окислительные и восстановительные свойства нитритов
· К 1-2 мл раствора нитрита калия KNO2 прилить 0,5-1 мл раствора йодида калия KI и столько же разбавленной серной кислоты.
· Налить в пробирку 1-2 мл раствора дихромата калия K2Cr2O7, добавить 2-3 мл раствора нитрита калия и разбавленной серной кислоты.
Требования к результатам опыта:
1. Закончить уравнения реакций:KNO2 + KI + H2SO4 =
K2Cr2O7 + KNO2 + H2SO4 =
В каждой реакции указать окислитель и восстановитель.
2. Сделать вывод об окислительно-восстановительных свойствах нитритов.
Задачи
№ 26.1. Привести не менее трех примеров реакций, в которых азот играет роль окислителя, и пример реакции, в которой он является восстановителем.
№ 26.2. Привести примеры характерных для аммиака реакций присоединения и окисления без катализатора и в присутствии катализатора.
№ 26.3. Нитрат аммония может разлагаться двумя путями:
NH4NO3 (к) = N2O (г) + 2H2O (г)
NH4NO3 (к) = N2 (г) + 1/2O2 (г) + 2H2O (г)
Какая из приведенных реакций наиболее вероятна при 298 К? Ответ подтвердить расчетом 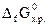 . (
. ( 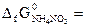 -183,9 кДж/моль;
-183,9 кДж/моль; 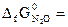 104,1 кДж/моль;
104,1 кДж/моль; 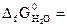 -228,6 кДж/моль).
-228,6 кДж/моль).
№ 26.4. Какова реакция среды в растворах KNO3, NH4NO3, NaNO2, NH4NO2? Составить молекулярные и ионные уравнения реакций гидролиза этих солей.
№ 26.5. Закончить уравнения реакций:
а) Zn + NaNO3 + NaOH 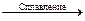 ; б) NO + KMnO4 + H2O =;
; б) NO + KMnO4 + H2O =;
в) Cu + HNO3 (разб.); г) AgNO3 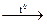
№ 26.6. Написать уравнения взаимодействия разбавленной азотной кислоты с ртутью, магнием, фосфором, углем (С).
№ 26.7. Сколько нитрита аммония NH4NO2 требуется для получения 1 л азота при нормальных условиях? (Ответ: 2,86 г).
№ 26.8. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Составить уравнения реакций HNO2:
а) с бромной водой (Br2); б) с HI.
№ 26.9. Почему диоксид азота (NO2) способен к реакциям диспропорционирования? Написать уравнения реакций взаимодействия NO2:
а) с водой; б) гидроксидом натрия.
№ 26.10. Закончить уравнения реакций: а) N2O5 + KOH =;
б) N2O3 + NaOH =; в) Cu + HNO3 (разб) =; г) NO2 + O2 + Н2О=
№ 26.11. В каком газообразном соединении азот проявляет свою низшую степень окисления? Написать уравнения реакций получения этого соединения: а) при взаимодействии хлорида аммония с гидроксидом кальция; б) разложением нитрида магния водой.
№ 26.12. Почему азотистая кислота способна к реакциям диспропорционирования? Написать уравнение реакции разложения НNO2, учитывая, что при этом азот приобретает степень окисления +2 и + 5.
№ 26.13. Составить уравнения реакций окисления азотной кислотой: а) серы до серной кислоты; б) фосфора до фосфорной кислоты Н3РО4; в) углерода до диоксида углерода.
№ 26.14. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
N2 → NO → NO2 → HNO3 → NH4NO3
№ 26.15. Закончить уравнения реакций получения аммиака:
а) H2 + N2 =; б) NH4OH 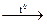 ; в) AlN + H2O =; г) NH4Cl + Ca(OH)2 =
; в) AlN + H2O =; г) NH4Cl + Ca(OH)2 =
№ 26.16. Как получить NH4NO3, воспользовавшись в качестве исходных веществ атмосферным азотом и водой?
№ 26.17. Закончить уравнения реакций получения в промышленности азотной кислоты: а) NH3 + O2 =; б) NO + O2 =; в) NO2 + H2O + O2 =
№ 26.18. Закончить уравнения реакций разложения азотной кислоты и ее солей: а) HNO3 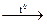 ; б) Hg(NO3)2
; б) Hg(NO3)2 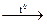 ; в) Pb(NO3)2
; в) Pb(NO3)2 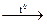 ; г) NaNO3
; г) NaNO3 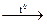
№ 26.19. Закончить уравнения реакций: а) KNO2 + KMnO4 + H2O =
б) KI + HNO2 + H2SO4 = NO + …; в) Na2S + NaNO2 + H2SO4 = S + NO + …;
№ 26.20. Привести примеры характерных для аммиака реакций присоединения и окисления.
Дата добавления: 2015-09-11; просмотров: 1898;
