Выполнение работы. Опыт 1. Поведение серы при различных температурах
Опыт 1. Поведение серы при различных температурах
Сухую пробирку на 1/3 ее объема наполнить серой и медленно нагревать на пламени спиртовки, все время встряхивая. Следить за изменением вязкости и цвета расплавленной серы. Кипящую серу тонкой струей вылить в стакан с холодной водой. Слить воду из стакана и убедиться в пластичности серы. Кусочек пластической серы оставить до конца занятия. Сохраняет ли она свои свойства?
Требование к результатам опыта:
Дать объяснение всем наблюдаемым при опыте изменениям.
Опыт 2. Получение и свойства сероводорода
(Проводить под тягой!). Поместить в пробирку 1 шпатель сульфида железа FeS, укрепить ее вертикально в зажиме штатива и прилить 1-2 мл разбавленной соляной кислоты. Быстро закрыть пробирку пробкой с газоотводной трубкой и слегка подогреть. Когда начнется энергичное выделение газа, поднести к отверстию трубки поочередно полоски влажной индикаторной бумаги и фильтровальной бумаги, смоченной раствором соли свинца. Что наблюдается?
Выделяющийся из пробирки газ зажечь у отверстия трубки. Подержать над пламенем влажную индикаторную бумагу. Что наблюдается?
Внести в пламя горящего сероводорода фарфоровую чашку и наблюдать появление на ней желтого пятна.
Требования к результатам опыта:
1. Составить уравнение реакции получения сероводорода.
2. Сделать вывод о кислотно-основных свойствах сероводорода.
3. Закончить уравнения реакций: H2S + Pb(NO3)2 =
H2S + O2 (избыток) =
H2S + O2 (недостаток) =
Опыт 3. Взаимодействие серы со щелочами
В пробирку поместить 1 шпатель порошка серы и прилить 3-4 мл концентрированного раствора щелочи. Содержимое пробирки прокипятить до пожелтения раствори. Раствор сохранить для следующих опытов.
Требование к результатам опыта:
Закончить уравнение реакции S + NaОН =, указать окислитель и восстановитель и сделать вывод, к какому типу ОВР относится данная реакция.
Опыт 4. Восстановительные свойства сульфидов и сульфитов
Налить в пробирку 1-2 мл раствора перманганата калия KMnO4, подкислить его разбавленной серной кислотой и прибавить немного раствора, полученного в опыте 3. Что наблюдается?
Требования к результатам опыта:
1. Закончить уравнения реакций: KMnO4 + Na2S + H2SO4 =
KMnO4 + Na2SO3 + H2SO4 =
В каждой реакции указать окислитель и восстановитель.
2. Сделать вывод, какими свойствами, окислительными или восстановительными, обладают сульфиды.
Опыт 5. Окислительные свойства сульфитов
К 1-2 мл раствора, полученного в опыте 3, прилить несколько капель разбавленной соляной кислоты. Что происходит?
Требования к результатам опыта:
1. Закончить уравнение реакции: Na2SО3 + HCl =
2. Сделать вывод об окислительно-восстановительных свойствах сульфитов.
Опыт 6. Окислительные свойства серной кислоты
В две сухие пробирки поместить по маленькому кусочку серы и угля, налить в них по 1-2 мл концентрированной серной кислоты. Пробирки осторожно нагреть и наблюдать постепенное окисление неметаллов.
Требование к результатам опыта:
Написать уравнения реакций окисления серы и угля (С) концентрированной серной кислотой.
Опыт 7. Водоотнимающее свойство серной кислоты
· В пробирку налить 1-2 мл концентрированной серной кислоты и опустить в нее лучинку.
· В пробирку насыпать 2 шпателя CuSO4∙5Н20 и добавить 1-2 мл концентрированной серной кислоты.
Требование к результатам опыта:
Объяснить наблюдаемые явления.
Задачи
№ 25.1. Закончить уравнения реакций: а) KMnO4 + H2S + H2SO4 =;
б) H2S + H2O2 =; в) H2S + NaOH =; г) Na2S + H2O ↔
№ 25.2. Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? Составить уравнения реакций взаимодействия H2SO3: а) с сероводородом; б) с кислородом.
№ 25.3. Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Написать уравнения реакций взаимодействия разбавленной серной кислоты с магнием и алюминием и концентрированной – с медью и серебром.
№ 25.4. Сколько литров диоксида серы SO2 при нормальных условиях можно получить при сжигании серы массой 500 г? (Ответ: 350 л).
№ 25.5. Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при взаимодействии: а) с магнием; б) с иодом;
в) с сероводородом? Составить уравнения соответствующих реакций.
№ 25.6. Можно ли окислить сероводород кислородом при 298 К? Ответ мотивировать, вычислив ΔG0 реакции: 2H2S (г) + O2 (г) = 2S (к) + 2H2O (ж).
( 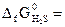 -33,8 кДж/моль;
-33,8 кДж/моль; 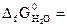 -237,3 кДж/моль). (Ответ: -407 кДж).
-237,3 кДж/моль). (Ответ: -407 кДж).
№ 25.7. Раствор, содержащий 5,12 г серы в 100 г сероуглерода CS2, кипит при 46,67 оС. Температура кипения чистого сероуглерода 46,20 оС. Эбулиоскопическая константа сероуглерода 2,37. Вычислить молекулярную массу серы и установить, из скольких атомов состоит молекула серы. (Ответ: 258; S8).
№ 25.8. Через 100 мл 0,2 н раствора NaOH пропустили 448 мл SO2 (н.у.). Какая соль образовалась? Найти ее массу. (Ответ: NaHSO3; 2,08 г).
№ 25.9. Закончить уравнения реакций: а) H2S + SO2 =; б) H2SO3 + I2 =;
в) KMnO4 + SO2 + H2O =; г) HIO3 + H2SO3 =
№ 25.10. Привести примеры уравнений реакций (не менее двух на каждый случай) получения SO2, которые: а) сопровождаются изменением степени окисления серы; б) не сопровождаются изменением степени окисления серы.
№ 25.11. Закончить уравнения реакций: а) S + KOH =; б) HNO2 + H2S =;
в) Na2S + NaNO3 + H2SO4 =; г) H2S + KMnO4 + H2O =
№ 25.12. Написать уравнение реакции получения сернистого газа (SO2) из железного колчедана (FeS2). Рассчитать объем SO2 (н.у.), который получится при окислении 1,5 кг железного колчедана. (Ответ: 560 л).
№ 25.13. Закончить уравнения реакций гидролиза в молекулярном и ионном виде: а) Na2S + H2O ↔; б) (NH4)2S + H2O =;
в) Al2S3 + H2O =; г) Cr2(SO4)3 + Na2S + H2O =
№ 25.14. Закончить уравнения реакций взаимодействия серной кислоты с металлами: а) Cu + H2SO4 (конц.) =; б) Mg + H2SO4 (конц.) =;
в) Hg + H2SO4 (конц.) =; г) Ni + H2SO4 (разб.) =
№ 25.15. В 10 л воды растворили 2,24 л газообразного триоксида серы SO3 (н.у.). Рассчитать молярную и молярную концентрацию эквивалентов полученного при этом раствора серной кислоты. (Ответ: 0,008 моль/л; 0,016 моль/л).
№ 25.16. Сколько миллилитров концентрированной серной кислоты
(ρ = 1,84 г/мл), содержащей 98 % H2SO4, теоретически необходимо для перевода в раствор 10 г меди? Какой объем SO2 (н.у.) выделится при этом?
(Ответ: 17 мл; 3,52 л).
№ 25.17. Определить молярную концентрацию эквивалентов раствора Na2SO3, если при окислении 20 мл его в кислой среде требуется 16 мл 0,05 н раствора KMnO4. (Ответ: 0,04 н).
№ 25.18. Сколько литров Н2S (н.у.) потребуется для восстановления в сернокислом растворе 100 мл 5,7 %-ного раствора K2Cr2O7 (ρ = 1,04 г/мл)?
(Ответ: 1,35 л).
№ 25.19. Какими тремя способами можно получить сероводород, имея в своем распоряжении цинк, серу, водород и серную кислоту? Составить уравнения соответствующих реакций.
№ 25.20. Закончить уравнения реакций окисления концентрированной серной кислотой следующих веществ:
а) Zn + H2SO4 =; б) KI + H2SO4 =; в) C + H2SO4 =
Дата добавления: 2015-09-11; просмотров: 1286;
