Выполнение работы. Опыт 1. Взаимодействие алюминия с кислородом и водой
Опыт 1. Взаимодействие алюминия с кислородом и водой
Две алюминиевые проволоки зачистить наждачной бумагой. В пробирку налить 2-3 мл концентрированного раствора NaОН, нагреть его и опустить туда алюминиевые проволоки на 2-3 секунды. Затем сполоснуть их водой и опустить в раствор соли ртути, налитой в пробирку. Снова сполоснуть проволоки и обсушить фильтровальной бумагой. Одну из проволок опустить в воду, а другую оставить на воздухе. Отметить протекающие изменения с проволоками.
Требования к результатам опыта:
1. Объяснить, с какой целью алюминиевые проволоки обрабатывают растворами NaОН и Hg(NO3)2.
2. Закончить уравнения реакций:
Al + H2O =;
Al + O2 + H2O =
Опыт 2. Получение и свойства гидроксида алюминия
В две пробирки налить по 1-2 мл раствора соли алюминия и в каждую пробирку добавить по каплям раствор щёлочи до образования осадка. В первой пробирке на осадок подействовать разбавленной HCl, во второй – раствором NaOH. Что наблюдается?
Требования к результатам опыта:
1. Написать молекулярные и ионные уравнения реакций получения Al(OH)3 и взаимодействия Al(OH)3 с кислотой и щёлочью.
2. Составить уравнение диссоциации Al(OH)3 по типу кислоты и по типу основания.
3. Сделать вывод о кислотно-основных свойствах гидроксида алюминия.
Опыт 3. Получение и свойства гидроксидов олова (II) и свинца (II)
В одну пробирку налить 2-3 мл раствора соли олова, в другую – такое же количество соли свинца. В обе пробирки по каплям добавить щёлочи до образования осадка.
Для испытания образовавшихся осадков содержимое каждой из пробирок разделить на две части. К одной из них добавить разбавленной HNO3, к другой – концентрированной щёлочи. Размешать растворы до растворения осадков.
Требования к результатам опыта:
1. Написать уравнения реакций получения гидроксидов олова (II) и свинца (II).
2. Составить уравнения реакций взаимодействия Sn(OH)2 и Pb(OH)2 с кислотой и щёлочью.
3. Составить уравнение диссоциации М(ОН)2 по типу кислоты и по типу основания.
4. Сделать вывод о кислотно-основных свойствах гидроксидов олова (II) и свинца (II).
Опыт 4. Восстановительные свойства соединений олова (II)
Восстановление перманганата калия
В пробирку налить 3-4 мл раствора KMnO4, добавить 1-2 мл разбавленной HCl и прилить раствор SnCl2 до обесцвечивания раствора.
Восстановление дихромата калия
В пробирку налить 4-5 мл раствора K2Cr2O7, добавить 2-3 мл разбавленной HCl и прилить по каплям раствор SnCl2 до появления зелёной окраски.
Опыт 5. Окислительные свойства оксида свинца (IV)
В пробирку налить 3-4 мл раствора HNO3, добавить шпатель PbO2 и 1 мл раствора MnSO4. Содержимое осторожно прокипятить, дать отстояться и отметить окраску раствора.
Требования к результатам опытов 4, 5:
1. Закончить уравнения реакций: KMnO4 + SnCl2 + HCl =
K2Cr2O7 + SnCl2 + HCl =
PbO2 + MnSO4 + HNO3 =
2. Сделать вывод об окислительно-восстановительных свойствах соединений олова и свинца.
Задачи
№ 18.1. Составить уравнения реакций, которые нужно провести для осуществления следующих превращений:
Al → Al2(SO4)3 → Al(OH)3 → Na[Al(OH)4] → Al(NO3)3
№ 18.2. Чем можно объяснить восстановительные свойства соединений олова (II) и окислительные свойства соединений свинца (IV)? Закончить уравнения реакций:
а) SnCl2 + HgCl2 =; б) KCrO2 + PbO2 + KOH = K2CrO4 + ….
№ 18.3. Какие оксиды и гидроксиды образует олово? Как изменяются их кислотно-основные свойства в зависимости от степени окисления олова? Закончить уравнения реакций:
а) SnO2 + KOH =; б) SnO + H2SO4 =; в) Sn(OH)2 + NaOH =
№ 18.4. При сжигании 18 г алюминия в кислороде выделилось 558 кДж теплоты. Определить энтальпию образования оксида алюминия.
(Ответ: −1674 кДж).
№ 18.5. Закончить уравнения окислительно-восстановительных реакций:
а) PbO2 + Cr(NO3)3 + NaOH = Na2CrO4 + …; б) SnCl2 + FeCl3 =
№ 18.6. Написать уравнения реакций взаимодействия металлов с кислотами:
а) Sn + H2SO4 (разб.) =; б) Pb + HNO3 (конц.) =; в) Sn + HNO3 (конц.) =
№ 18.7. Закончить в молекулярном и ионном виде уравнения реакций гидролиза солей: а) AlCl3 + H2O ↔; б) SnSO4 + H2O ↔; в) Pb(NO3)2 + H2O ↔
№ 18.8. Какие оксиды и гидроксиды образует свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления свинца? Закончить уравнения реакций:
а) PbO2 + NaOH =; б) PbO + HNO3 =; в) Pb(OH)2 + KOH =
№ 18.9. Рассчитать ΔG0х.р. и установить возможность самопроизвольного протекания реакции 4Al + 3CO2 =2Al2O3 + 3C. (  кДж/моль;
кДж/моль; 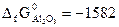 кДж/моль).
кДж/моль).
№ 18.10. Закончить уравнения реакций: а) Al + HCl =;
б) Sn + HNO3 (разб.) =; в) Pb + HNO3 (разб.)=; г) Al + KOH + H2O =
№ 18.11. Вычислить 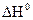 реакции восстановления оксида свинца углем с образованием СО. (
реакции восстановления оксида свинца углем с образованием СО. (  кДж/моль;
кДж/моль;  кДж/моль).
кДж/моль).
(Ответ: 108,8 кДж).
№ 18.12. Как можно получить α-оловянную кислоту, а затем перевести ее в раствор? Написать соответствующие уравнения реакций.
№ 18.13. При электролизе водного раствора SnCl2 на аноде выделилось 4,48 л хлора (условия нормальные). Найти массу выделившегося на катоде олова. (Ответ: 23,7 г)
№ 18.14. Каким образом можно перевести в раствор металлический свинец? Составить соответствующие уравнения реакций.
№ 18.15. Составить схемы электролиза водного раствора Pb(NO3)2, если:
а) анод свинцовый; б) анод угольный.
№ 18.16. Как можно перевести в раствор металлическое олово? Составить соответствующие уравнения реакций.
№ 18.17. К раствору, содержащему SnSO4 и Pb(NO3)2, прибавили избыток раствора КОН. Составить молекулярные и ионные уравнения реакций.
№ 18.18. Как можно перевести в раствор металлический алюминий? Составить соответствующие уравнения реакций.
№ 18.19. Закончить уравнения реакций:
а) SnCl2 + KMnO4 + H2SO4 = Sn(SO4)2 + …; б) PbO2 + Na3CrO3 + NaOН =
№ 18.20. Закончить уравнения реакций:
а) Al + KMnO4 + H2SO4 =; б) AlCl3 + Na2CO3 + H2O =
Дата добавления: 2015-09-11; просмотров: 1308;
