Выполнение работы
Опыт 1. Взаимодействие щелочных металлов с водой (групповой)
Налить в кристаллизатор воды. Пинцетом достать кусочек металлического натрия из склянки, где он хранится под слоем керосина, и высушить его фильтровальной бумагой. Ножом отрезать кусочек металла с величиной со спичечную головку. Обратить внимание на потускнение металлической поверхности свежего надреза. Пинцетом перенести металл в кристаллизатор с водой. По окончании реакции к полученному раствору прибавить 1-2 капли фенолфталеина.
Не наклоняться над кристаллизатором, так как под конец реакции происходит разбрызгивание металлической окалины, которая может причинить сильные ожоги.
Провести аналогичный опыт с калием.
Требования к результатам опыта:
1. Написать уравнения реакций взаимодействия натрия и калия с водой.
2. Сделать вывод об активности натрия и калия по отношению к воде.
Опыт 2. Свойства пероксида натрия
Взаимодействие с водой
В пробирку внести шпатель пероксида натрия Na2О2, добавить 1-2 мл воды, затем несколько капель фенолфталеина. Что наблюдается?
Окислительные свойства
Налить в пробирку 1-2 мл раствора иодида калия KI, добавить такое же количество разбавленной серной кислоты и насыпать шпатель пероксида натрия. Что происходит?
Восстановительные свойства
Налить в пробирку 1-2 мл раствора перманганата калия KMnO4, добавить шпатель пероксида натрия и перемешать. Отметить изменение окраски раствора.
Требования к результатам опыта:
1. Написать уравнение реакции гидролиза пероксида натрия и сделать вывод, солью какой кислоты является Na2О2.
2. Закончить уравнения окислительно-восстановительных реакций:
Na2О2 + KI + Н2SO4 =;
Na2О2 + KMnO4 + Н2О =,
в каждой реакции указать окислитель и восстановитель.
3. Сделать вывод об окислительно-восстановительных функциях Na2О2.
Опыт 3. Горение магния на воздухе (групповой)
Взять пинцетом кусочек магниевой стружки и внести в пламя спиртовки. После воспламенения сжечь его над фарфоровой чашкой. К собранному в чашке оксиду магния прилить несколько капель воды, хорошо перемешать и добавить 1-2 капли фенолфталеина. Объяснить появление окраски. С какими составными частями воздуха вступает во взаимодействие магний?
Требование к результатам опыта:
Составить уравнения реакций взаимодействия магния с кислородом, азотом и продуктов их взаимодействия с водой.
Опыт 4. Взаимодействие кальция и магния с водой
В три пробирки налить по 3-4 мл воды и в каждую добавить по несколько капель фенолфталеина. В одну пробирку пинцетом внести кусочек кальция, в две другие – по кусочку магния. Наблюдать за протеканием реакций. Одну из пробирок с магнием нагреть, в другую пробирку с магнием добавить раствора хлорида аммония.
Требования к результатам опыта:
1. Написать уравнения реакций взаимодействия:
а) кальция с водой; б) магния с водой; в) магния с водой и NH4Cl.
2. Объяснить влияние нагревания и присутствия хлорида аммония на реакцию взаимодействия магния с водой.
3. Сделать вывод об активности кальция и магния по отношению к воде.
Задачи
№ 16.1. Написать уравнения реакций натрия с водородом, кислородом, азотом, серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
№ 16.2. Написать уравнения реакций с водой следующих соединений натрия: Na2O2, Na2S, NaH, Na3N.
№ 16.3. Как получают металлический натрий? Составить электронные уравнения процессов, происходящих на электродах при электролизе расплава NaОH.
№ 16.4. Составить уравнения реакций получения гидрида, нитрида и карбида кальция и взаимодействия этих соединений с водой.
№ 16.5. Закончить уравнения реакций: а) Li2O + CO2 =;
б) Na2O2 + Na2SO3 + H2O =; в) K2S + H2O ↔; г) NaCl + K[Sb(OH)6] =
№ 16.6. Составить уравнения реакций, которые нужно провести для осуществления следующих превращений:
Са → СаН2 → Са(ОН)2 → СаСО3 → Са(НСО3)2
№ 16.7. Гидроксид какого из s-металлов проявляет амфотерные свойства? Составить молекулярные и ионные уравнения реакций этого гидроксида:
а) с кислотой; б) со щелочью.
№ 16.8. Составить уравнения реакций: а) бериллия с раствором щелочи;
б) кальция с соляной кислотой; в) магния с концентрированной серной кислотой.
№ 16.9. При сплавлении оксид бериллия взаимодействует с диоксидом кремния и с оксидом натрия. Написать уравнения соответствующих реакций. О каких свойствах ВеО свидетельствуют эти реакции?
№ 16.10. Какая масса гидроксида калия образовалась у катода при электролизе раствора К2SO4, если на аноде выделилось 11,2 л кислорода (н.у.)?
(Ответ: 112 г).
№ 16.11. Вычислить молярную концентрацию водного раствора КОН, полученного при растворении 1,5 г щелочи в 48,5 воды. Плотность раствора 1,027 г/мл. (Ответ: 0,53 моль/л).
№ 16.12. Вычислить энтальпию образования MgO, исходя из уравнения реакции: MgO + C = Mg + CO, ΔH0 = 491,3 кДж. (Δ f H0CO = -110,5 кДж/моль).
(Ответ: -601,8 кДж).
№ 16.13. Вычислить количество теплоты, которое выделится при взаимодействии 8 г гидрида натрия с водой. Стандартные энтальпии образования NaH, NaOH, H2O (ж) принять соответственно равными -56,4; -425,6 и -285,8 кДж/моль. (Ответ: 28,8 кДж).
№ 16.14. Каким объемом 35 %-ного раствора КОН (ρ= 1,34 г/см3) можно заменить 10 л 4 н раствора КОН? (Ответ: 4,78 л).
№ 16.15. Закончить уравнения реакций:
а) Na2O2 + KNО2 + H2SO4 =; б) L3N + H2O =; в) K + O2 =; г) CaCO3 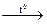
№ 16.16. Написать уравнения реакций лития с водородом, кислородом, азотом, серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
№ 16.17. При электролизе водного раствора NaOH на аноде выделилось 2,8 л кислорода (н.у.). Сколько водорода выделится на катоде? (Ответ: 5,6 л).
№ 16.18. Вычислить ΔG0 реакции горения магния в диоксиде углерода. Энергии Гиббса образования MgO, СО2, СО принять соответственно равными (кДж/моль): -569,6; -394,4; -137,1. Возможно ли самопроизвольное протекание этой реакции? (Ответ: -312,6 кДж).
№ 16.19. Можно ли получить кальций восстановлением его оксида алюминием? Ответ обосновать расчетом энергии Гиббса реакции. Энергии Гиббса образования СаO и Al2O3 принять соответственно равными -604,2 и -1582 кДж/моль.
№ 16.20.Закончить уравнения реакций:
а) Be + KOH + H2O =; б) Li2C2 + H2O =; в) Mg + H2O =; г) Na2SO3 + H2O ↔
Дата добавления: 2015-09-11; просмотров: 1467;
