Опыт 4. Действие щелочи на металлы
В две пробирки налить по 2-3 мл концентрированного раствора щелочи. В одну из них насыпать небольшое количество цинковых опилок, в другую – алюминиевого порошка. Если реакция не идет, слегка нагреть. Когда начнется интенсивное выделение газа, поднести к отверстиям пробирок зажженную лучинку. Что наблюдается?
Требования к результатам опыта:
1. Составить уравнения реакций взаимодействия цинка и алюминия с раство ром щелочи.
2. Сделать вывод, какие металлы реагируют со щелочами.
Задачи
№ 14.1. Закончить и уравнять реакции:
а) Ba + H2O =; б) Sn + NaOH + H2O =;
в) Sn + HNO3 (разб.) =; г) Hg + H2SO4 (конц.) =
№ 14.2. Закончить и уравнять реакции:
а) Cd + H2SO4 (разб.)=; б) Be + NaOH + H2O =;
в) Bi + HNO3 (конц.) г) Li + H2O =
№ 14.3. Какие из перечисленных металлов (Mg, Mn, Hg, Au, Al, Cd, Ag) растворяются в разбавленной H2SO4? Написать уравнения реакций.
№ 14.4. Закончить и уравнять реакции:
а) Mg + HNO3 (разб.) =; б) Sn + KOH + H2O =;
в) Ni + H2SO4 (конц.) =; г) W + HNO3 + HF = H2[WF8] + …
№ 14.5. Закончить и уравнять реакции:
а) Ga + NaOH + H2O =; б) Bi + HNO3 (разб.) =;
в) La + H2O =*; г) Co + H2SO4 (конц.) =
*Электродный потенциал лантана -2,55 В.
№ 14.6. Закончить и уравнять реакции:
а) Rb + H2O =; б) W + Na2CO3 + NaNO3 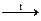 Na2WO4 + …;
Na2WO4 + …;
в) Be + KOH + H2O =; г) Sn + HCl =
№ 14.7. Закончить и уравнять реакции:
а) Pb + NaOH + H2O =; б) Fe + O2 =;
в) Ni + HNO3 (конц.) =; г) La + H2SO4 (разб.) =*
* Электродный потенциал лантана -2,55 В.
№ 14.8. Закончить и уравнять реакции:
а) Ga + H2SO4 (разб.) =*; б) Cd + HNO3 (конц.) =;
в) Sr + H2O =*; г) Al + C 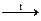
* Электродный потенциал стронция -2,88 В, галлия -0,53 В.
№ 14.9. Закончить и уравнять реакции:
а) Mn + HNO3 (разб.) =; б) Al + KOH + H2O =;
в) Ca + H2O =; г) Fe + H2SO4 (разб.) =
№ 14.10. Закончить и уравнять реакции:
а) Ta + HNO3 + HF = H2[TaF7] + …; б) Cs + H2O =;
в) Ag + HNO3 (разб.) =; г) Al + HCl =
№ 14.11. Закончить и уравнять реакции:
а) Zr + HNO3 + HCl = ZrCl4 + …; б) Rb + H2O =;
в) Mn + HNO3 (конц.) =; г) Sn + KOH + H2O =
№ 14.12. Закончить и уравнять реакции:
а) Mo + NaNO3 + NaOH 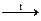 Na2MoO4 + …; б) Ni + H2SO4 (разб.) =;
Na2MoO4 + …; б) Ni + H2SO4 (разб.) =;
в) Ni + H2SO4 (конц.) =; г) Mg + H2O 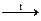
№ 14.13. Закончить и уравнять реакции:
а) Na + H2 =; б) Zn + CH3COOH =;
в) Sn + H2SO4 (конц.) =; г) Ca + HNO3 (оч. разб.) =
№ 14.14. Закончить и уравнять реакции:
а) Hg + HNO3 + HCl = HgCl2 + …; б) Co + HNO3 (конц.) =;
в) K + H2O =; г) Sc + H2SO4 (разб.) =*
* Электродный потенциал скандия -2,01 В.
№ 14.15. Какие из перечисленных металлов (Cu, Ca, Hg, Au, Fe, Cr, Ag, Al) растворяются в HCl? Написать уравнения реакций.
№ 14.16. Закончить и уравнять реакции:
а) Nb + HNO3 + HF = H2[NbF7] + …; б) Li + N2 =;
в) Pb + KOH + H2O =; г) Fe + HNO3 (разб.) =
№ 14.17. Закончить и уравнять реакции:
а) V + KOH + O2 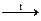 КVО3 + …; б) Sn + HNO3 (конц.) = H2SnO3 + …;
КVО3 + …; б) Sn + HNO3 (конц.) = H2SnO3 + …;
в) Ag + H2SO4 (конц.) 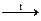 ; г) Mn + H2SO4 (разб.) =
; г) Mn + H2SO4 (разб.) =
№ 14.18. Закончить и уравнять реакции:
а) Pt + HNO3 + HCl = H2[PtCl6] + …; б) Fe + H2SO4 (конц.) 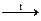 ;
;
в) Al + S 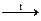 ; г) Sn + KOH + H2O =
; г) Sn + KOH + H2O =
№ 14.19. Закончить и уравнять реакции:
а) Fe + Cl2 =; б) Be + KOH + H2O =;
в) Cd + HNO3 (разб.) =; г) Sn + H2SO4 (разб.) =
№ 14.20. Закончить и уравнять реакции:
а) Ca + H2 =; б) Mn + HCl =;
в) Mo + Na2CO3 + NaNO3 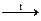 Na2MoO4 + …; г) Cd + HNO3 (разб.) =
Na2MoO4 + …; г) Cd + HNO3 (разб.) =
Дата добавления: 2015-09-11; просмотров: 1744;
