Классификация посуды.
Лекция 2. Лабораторная посуда и оборудование.
План.
1. Общая характеристика лабораторной химической посуды.
2. Классификация посуды: мерная, общего и специального назначения.
3. Правила обращения со стеклянной посудой. Уход за лабораторной посудой: мытьё и сушка различных видов лабораторной посуды, правила хранения стеклянной посуды.
4. Вспомогательные принадлежности.
5. Лабораторные нагревательные приборы.
Д.з. по уч. Пустоваловой стр. 14-62.
Лабораторная посуда общего назначения.
Посуда химическая лабораторная, изделия из стекла, кварца, фарфора, металлов и др. материалов применяются для препаративных и химико-аналитических работ. Лабораторная посуда устойчива к воздействию химических реагентов, легко отмывается от загрязнений, а материал её термоустойчив и обладает малым коэффициентом теплового расширения.
Классификация посуды.
1. По изготовленному материалу: 1) стеклянная посуда;
2) фарфоровая и высокоогнеупорная (кварцевая) посуда;
3) пластиковая посуда.
2. По назначению она разделена на посуду общего назначения, мерную и специального применения.
К группе общего назначения относятся те предметы, которые всегда должны быть в лаборатории и без которых нельзя провести большинство работ.
К немерной, или общего назначения, посуде химической лабораторной относятся: пробирки, химические стаканы, воронки простые и делительные, кристаллизаторы, цилиндры, мензурки, колбы плоскодонные и конические Эрленмейера, пипетки, автоматические пипетки (дозаторы), бюретки, микробюретки, эксикаторы, склянки, хлоркальцевые трубки, дефлегматоры, холодильники.
1. Изделия, употребляемые с нагревом:
1) пробирки с рантом (5-25 мл),
2) стаканы химические (5-1000 мл),
3) колбы (10-1000 мл, плоскодонные, круглодонные, конические),
4) реторты с тубусом и без тубуса (до 3 л).
2. Употребляемые без нагрева изделия:
А) пробирки конические (из толстостенного стекла) для центрифугирования,
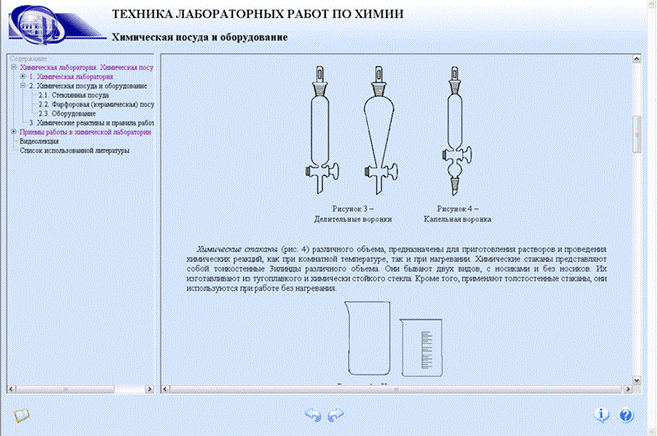
Б) воронки (для переливания и фильтрования жидкостей) обычные, аналитические, капельные воронки (от 25 мл и выше, цилиндрические, грушевидные и шарообразные),
В) цилиндры (от 10 мл до 500мл),
Г) мензурки (от 50 мл до 250 мл) без носика и с носиком,
Д) стаканы сахарные с носиком и без носика,
Е) пипетки для измерения объёма жидкостей,
Ж) бюретки и микробюретки для титрования,
З) кристаллизаторы применяются для охлаждения растворов,
И) холодильники для охлаждения и конденсации паров и собирания конденсата (специальные и универсальные),
К) стеклянная палочка различной толщины и длины используется для перемешивания жидкостей,
Л) колбы плоскодонные, конические Эрленмейера,
М) чашки Петри, капельницы, промывалки, водоструйный насос и др.
Мерная посуда химическая лабораторная имеет точную градуировку, её нельзя нагревать. Мерная посуда, как и вся посуда химическая различается по ёмкости, диаметру и формам. К ней относятся:
1) пипетки градуированные лабораторные - для отбора жидкостей Мора (0,1-100 мл) и газов (от 100 мл и выше), пипетки типа Сали (0,02-0,04 мл), пипетки Пятницкого, микропипетки и автоматические пипетки (дозаторы);
2) бюретки (1-100 мл) - для титрования, измерения точных объёмов (различают микробюретки, бюретки объёмные, весовые, поршневые, газовые);
3) мерные колбы (10-2000 мл) - для отмеривания и хранения определённых объёмов жидкостей;
4) мерные мензурки (градуированы менее точно);
5) мерные цилиндры;
6) пробирки.
Кгруппе посуды специального назначения относятся те предметы, которые употребляются для одной какой-то цели.
Лабораторная посуда специального назначения:
из стекла – колба Бунзена, колба Вюрца, делительные воронки и Шотта, промывные склянки, склянка Тищенко, склянка Вульфа, хлор-кальциевые трубки, капельницы, чашки Петри, бюксы, пастеровские пипетки, промывалки, эксикаторы, дефлегматоры, холодильник Либиха, водоструйный насос;
из фарфора – фарфоровые чашки, фарфоровые тигли Гуча, ступки (фарфоровые, медные, агатовые), воронки Бюхнера.
Стеклянная посуда:
– пробирка - это самая незаменимая посуда в лаборатории, изготавливается из стекла и полиэтилена, предназначена для проведения самых разных опытов;
– стеклянная палочка различной толщины и длины используется для перемешивания жидкостей;
– часовое стекло применяется для исследования твердых веществ, им накрывают стаканы при проведении синтезов;
– воронка используется для переливания жидкостей и для фильтрования;
– химический стакан различного объема предназначен для приготовления растворов и проведения реакций при комнатной температуре или нагревании;
– колба плоскодонная применяется для приготовления и хранения растворов;
– колба круглодонная - для проведения синтезов;
– чашка Петри используется для высушивания различных веществ;
– кристаллизатор применяется для охлаждения растворов и при сборе газов;
– цилиндр - для собирания газов.
Мерная посуда:
– мерный цилиндр используется для измерения довольно больших объемов жидкостей;
– пипетка применяется для точного измерения объема жидкости;
– мерная колба незаменима для приготовления растворов точной концентрации.
Фарфоровая посуда:
– ступка с пестиком предназначена для измельчения твердых веществ, перемешивания смесей;
– тигель используется для прокаливания веществ, для проведения различных синтезов при высоких температурах;
– треугольник необходим для закрепления тиглей, чашек на кольце штатива;
– выпарительная чашка предназначена для упаривания растворов на водяной бане;
– шпателем берут из склянок различные реактивы.
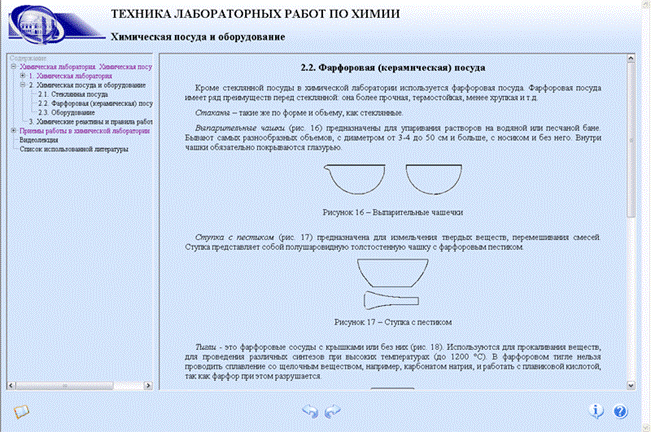 Из фарфоровой посуды чаще всего употребляются чашки для выпаривания разнообразной формы; обыкновенно их делают с носиками, чтобы удобнее было выливать из них жидкости. Чашки покрыты глазурью обыкновенно только с внутренней стороны и с краев. Они должны быть тонки, в особенности у дна, и равномерной толщины. Кроме чашек употребляются фарфоровые тигли для прокаливания с крышками; тонкость и равномерность стенок здесь еще более важны, чем для чашек, так как они должны выносить более значительные перемены температуры. Из фарфора делаются также ступки и пестики для растирания не особенно твердых веществ.
Из фарфоровой посуды чаще всего употребляются чашки для выпаривания разнообразной формы; обыкновенно их делают с носиками, чтобы удобнее было выливать из них жидкости. Чашки покрыты глазурью обыкновенно только с внутренней стороны и с краев. Они должны быть тонки, в особенности у дна, и равномерной толщины. Кроме чашек употребляются фарфоровые тигли для прокаливания с крышками; тонкость и равномерность стенок здесь еще более важны, чем для чашек, так как они должны выносить более значительные перемены температуры. Из фарфора делаются также ступки и пестики для растирания не особенно твердых веществ.
3. Уход за лабораторной посудой:мытьё и сушка различных видов лабораторной посуды, правила хранения стеклянной посуды.
Умение мыть химическую посуду является той частью лабораторной техники, знание которой необходимо для каждого работника лаборатории.
Химическая посуда должна быть совершенно чиста. Без этого условия работать нельзя. Поэтому научиться хорошо мыть посуду, мыть так, чтобы была полная уверенность в чистоте ее, является обязательным для работника лаборатории. Чистота посуды, в которой производится тот или иной опыт, важна как для аналитиков, так и для экспериментаторов и исследователей.
Удалить загрязнения со стенок посуды можно различными методами: механическими (мытьё водой), физическими (мытьё паром), химическими (мытьё органическими растворителями или СМС – синтетическим моющими средствами, мытьё хромовой смесью), физико-химическими методами или комбинируя их.
Для очистки грязной химической посуды прежде всего прибегают к промывке водой, когда удаляют вещества, в ней растворимые. Смотря по степени загрязнения, берется обыкновенная вода или дистиллированная, холодная или горячая.
Вещества, нерастворимые в воде, удаляются часто механическими путем, например, пробирки, конические колбы, при помощи щёток, ершей или трубки — бумагой, навернутой на длинную деревянную палочку, конец которой утыкан короткими металлическими шпильками, чтобы бумага не сползала с палочки;
колбы, реторты и пр. очищаются взбалтыванием с водой, в которую кладут клочки фильтровальной бумаги.
Во многих случаях вещества минеральные удаляются действием кислот соляной или азотной, или щелочами. Труднее всего очистка посуды от органических веществ. Их разлагают кипячением с крепкой азотной кислотой, царской водкой или нагреванием с хромовой смесью (раствор
K 2Cr2O7 в серной кислоте). В других случаях берутся какие-либо растворители: спирт, эфир, сероуглерод и пр.
Для примера возьмем пробирку, в которой был раствор Na2SO4 (сернокислый натрий), затем нальем в нее дистиллированной воды и добавим 2-3 капли раствора BaCl2 (хлористый барий), сразу же покажется муть вследствие образования BaSO4 (сернокислый барий) по следующему уравнению:
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
Если вылить эту муть и, не промыв пробирки, снова налить в нее дистиллированной воды и 2-3 капли раствора BaCl2, снова получим ту же картину.
Существует несколько способов мытья. Разберем их в отдельности.
а) Мытье водой. В тех случаях, когда химическая посуда не загрязнена осмолом, жировыми и другими не растворяющимися в воде веществами, посуда может мыться теплой водой. Для этой цели в каждой лаборатории должна быть горячая вода. Хорошо вымытая в теплой воде посуда обязательно 2-3 раза споласкивается дистиллированной водой. Для чего это делается?
Дело в том, что водопроводная вода содержит растворенные в ней соли. Если ограничиться мытьем только такой водой, то посуда не будет химически чистой. В этом легко убедиться, дав, например, высохнуть колбе, вымытой водопроводной водой. В тех местах, где были капли воды, всегда будет белый налет солей. Поэтому-то для удаления этих солей нужно несколько раз сполоснуть дистиллированной водой. Когда же посуда считается чистой? Посуда считается чистой тогда, когда, сполоснув последний раз водой и перевернув ее, не увидим на стенках приставших капель. Если посуда чиста, вода стекает с нее, не оставляя капель.
Если на стенках пробирки, например, имелся налет каких-либо солей, какой-нибудь осадок, то для удаления его пробирку нужно очистить специальной щеткой (ершом) и уже затем домывать.
Мытье паром. Все же нужно сказать, что не всегда достаточно мыть посуду одной водой. Иногда требуется иметь посуду идеально чистой. В этих случаях особо высокая тщательность мытья достигается тем, что посуда моется струей водяного пара. Этот способ мытья является самым лучшим, но он мало применяется потому, что процесс мытья идет очень медленно и продолжается долго. Если обычно колбу можно вымыть, например, в 5-10 мин., то для мытья паром нужен минимум час.
После мытья паром посуду, не перевертывая, высушивают или чистым воздухом, или в сушильном шкафу, или же дают высохнуть просто на воздухе, но при этом заботятся о том, чтобы снова не загрязнить ее. Эту установку для мытья паром вообще можно рекомендовать иметь на всякий случай в каждой лаборатории.
в) Хромовая смесь. Очень часто в лабораториях для мытья посуды применяется хромовая смесь. Применение ее основывается на том, что хромово-кислые соли в кислом растворе являются сильными окислителями. Обыкновенно для приготовления хромовой смеси берут купоросное масло, добавляют в него около 5% (от веса купоросного масла) кристаллического размельченного в ступке в порошок двухромовокислого калия и осторожно нагревают в фарфоровой чашке на водяной бане до тех пор, пока весь двухромовокислый калий не перейдет в раствор. Почти во всех случаях, когда посуда не поддается обычному мытью и при ополаскивании на стенках образуются капли, употребляется слегка подогретая хромовая смесь. Последняя наливается в загрязненную посуду, сполоснутую вначале водой, до 1/3 - 1/4 объема, и ею осторожно и медленно обливают стенки сосуда. После этого хромовая смесь выливается обратно в тот же сосуд, в котором она хранится, причем при сливании ее моющаяся посуда поворачивается, чтобы хромовая смесь обмыла также и края, обычно больше всего загрязненные. Слив всю смесь, ее смывают не сразу, а дают посуде постоять одну или полторы минуты. Обмывание посуды после хромовой смеси производится сначала обыкновенной, лучше теплой, водой, а уже затем споласкивают дистиллированной водой. Иногда эту операцию с хромовой смесью приходится проделывать не один раз. Раз приготовленная хромовая смесь служит довольно долго. После длительного употребления её цвет из темно-оранжевого переходит в темно-зеленый, что и служит признаком ее дальнейшей непригодности для мытья. Нужно всегда помнить, что хромовая смесь очень сильно действует на животную и растительную ткань, и поэтому обращаться с ней следует осторожно.
Хромовая смесь не применяется, если посуда загрязнена такими веществами, как парафин, керосин, воск, минеральные масла и вообще продукты перегонки нефти. В этих случаях применяется мытье паром или органическими растворителями.
г) Марганцовокислый калий. Хорошим средством для мытья посуды, кроме хромовой смеси, является также раствор марганцовокислого калия. Обычно готовят 5-10%-ный раствор (чаще 5%-ный).
Раствор марганцовокислого калия также является сильным окислителем, причем особенно активными являются подкисленные серной кислотой и подогретые растворы. Для мытья посуды в лаборатории можно иметь заготовленный заранее 5%-ный раствор этой соли. Этот раствор наливается в посуду, которую нужно предварительно вымыть горячей водой и ершом или щеткой. Затем тонкой струей добавляется немного концентрированной серной кислоты. При этом происходит разогревание, вполне достаточное для того, чтобы все загрязнения на стенках быстро окислились. Серную кислоту следует брать без большого излишка, но такое количество, чтобы после добавления ее температура раствора была около 50 -60 oC. Обычно на 100 см3 раствора марганцовокислого калия бывает достаточно добавить 3-5 см3 кислоты.
Отработанный кислый раствор марганцовокислого калия обычно выливается и повторно не используется. Кислым раствором перманганата очень хорошо очищаются ртутные насосы, трубки барометров и пр.
г) Серная кислота и щелочь. Когда посуда загрязнена осмолом, который не растворяется в воде, а также в тех случаях, когда в лаборатории не имеется готовой хромовой смеси, посуду можно мыть, применяя крепкую серную кислоту (купоросное масло), а также и крепкий (до 40%) раствор щелочи (NaOH). Смолы по большей части растворяются или в кислоте или в щелочи, и вместо того чтобы для них тратить дорогие органические растворители, следует применять вначале или серную кислоту или щелочь. Для этой цели в посуду наливается кислота или щелочь в таком количестве, чтобы объем их равнялся объему осмола или был немного больше последнего, но так, чтобы еще можно было без риска встряхивать посуду.
Нужно всегда помнить, что обращение с крепкой серной кислотой и крепкой щелочью должно быть осторожным и что кислоту нельзя выливать в раковину. Загрязненная осмолом серная кислота или щелочь обязательно должны сливаться в специальную глиняную или стеклянную банку, которая всегда должна стоять около водопроводной раковины. Но нужно помнить, что сливать в одну банку кислоту и щелочь нельзя, так как при этом будет происходить нейтрализация, сопровождающаяся сильным разогреванием, вследствие чего содержимое банки может выбросить.
д) Органические растворители. К числу органических растворителей относятся: серный эфир, ацетон, спирт, петролейный эфир, бензин, скипидар, четыреххлористый углерод и др. Они применяются для удаления из посуды смолистых и других органических веществ, которые не растворяются ни в воде, ни в кислоте, ни в щелочи. Следует всегда помнить, что большинство из указанных растворителей огнеопасно, и операции с ними должны производиться подальше от огня. Также нужно помнить, что не следует выбрасывать эти загрязненные органические растворители. Их нужно собирать каждый в отдельности и время от времени регенерировать. Регенерация состоит в том, что загрязненный растворитель отгоняется.
Методы сушки химической посуды:
1) Холодная сушка без нагревания (на колышках, решётке или столе);
Чтобы ускорить высушивание, посуду ополаскивают спиртом, который испаряется легче воды. Иногда после спирта ополаскивают эфиром; тогда высушивание идет ещё быстрее.
2) Горячая сушка при нагревании (воздухом или в сушильном шкафу).
Чтобы высушить внутри мокрую посуду, когда этого нельзя достигнуть вытиранием полотенцем или фильтровальной бумагой, её при нагревании продувают воздухом.
Более удобны сушильные шкафы с двойными стенками. Одни из них устроены с циркуляцией внутри стенок продуктов горения газа, у других между стенками налита жидкость. Из первых очень полезен шкаф Виснега. Внутренность его и полочки сделаны из фаянса, дверки стеклянные. Наружные стенки из железа образуют футляр, открытый внизу и оканчивающийся вверху небольшой вытяжной трубой. Как раз под трубой фаянсовый потолок шкафа имеет круглое отверстие. Воздух входит в шкаф через отверстие, сделанное в дверке и выходит через трубу. Нагрев газом с помощью особой горелки, с большим числом тонких отверстий для выхода газа, дающей равномерный нагрев дна, но не развивающей особенно высоких температур.
Сушильные шкафы с двойными стенками, между которыми налита жидкость, являются наиболее простыми приборами для высушивания при постоянной температуре.
Дата добавления: 2015-09-11; просмотров: 24369;
